Введение
Развитие газо- и нефтедобывающей отрасли и создание вахтовых поселков, не имеющих централизованного водоснабжения, требуют решения проблемы по обеспечению населения качественной питьевой водой, отвечающей потребностям жизнедеятельности человека. Большинство таких объектов располагаются в Западно-Сибирском регионе, активно развивающемся в промышленном отношении. Несмотря на обилие открытых водоемов на территории Западной Сибири, единственным доступным источником питьевого водоснабжения являются подземные воды. Это связано с тем, что поверхностные воды являются экологически незащищенными от антропогенного воздействия, а заболоченность территорий приводит к загрязнению поверхностных вод гуминовыми веществами. Использование подземных вод ограничено повышенной концентрацией ионов железа, что характерно для Западно-Сибирского региона [5, 6] . Обогащение подземных вод железом происходит вследствие выщелачивания и растворения железистых минералов. Для обезжелезивания подземных вод существуют различные технологии, такие как аэрация, озонирование, обработка импульсным электрическим разрядом, использование специальных фильтрующих загрузок [3, 9]. В настоящее время востребованными являются электрохимические технологии, которые включают как классические электрохимические методы обработки воды, например электролиз с растворимым анодом, так и электроразрядные методы, заключающиеся в действии импульсного электрического разряда в слое металлической загрузки, помещенной в водный раствор, содержащий различные ионы [1, 7].
Целью настоящей работы является исследование эффективности удаления железа из реальных скважинных вод при использовании электрохимических способов обработки воды. В работе рассмотрены 2 метода – обработка воды в электролизере с растворимым железным анодом и обработка импульсными электрическими разрядами в слое металлических железных гранул (ИЭР).
Материалы и методы исследования
В качестве электрохимической установки использовали электролизер с растворимым железным анодом. Альтернативный метод, используемый в данной работе – электроразрядная установка, в которой при действии импульсов тока на металлическую загрузку возникают температурные и динамические эффекты, вызывающие плавление и разбрызгивание металла с образованием суспензии, состоящей из наночастиц железа. Конструкции установок и принципы работы данных методов детально описаны в [1, 7]. В табл.1 приведены технические характеристики используемых установок.
Технические характеристики электрохимических установок Таблица 1
|
Электролизер |
|
|
-материал электродов |
Fe |
|
-расстояние м/д электродами |
0,5 см |
|
-площадь электродов |
70,3 см2 |
|
- плотность тока |
0,1…3,0 мА/см2 |
|
- напряжение |
12 В |
|
Электроразрядная установка |
|
|
-материал электродов |
Fe |
|
расстояние м/д электродами |
10 см |
|
-максимальный ток разряда |
250 А |
|
-напряжение в импульсе |
500 В |
|
-частота следования импульсов |
300 с-1 |
|
-энергия импульса |
0,5 Дж |
|
Потребляемая мощность |
≤ 150 Вт ч |
Исходную и воду после электрохимической обработки анализировали по соответствующим методикам [4].
Результаты исследования и их обсуждение
Ранее было показано [8], что использование модельных растворов, имитирующих скважинную воду, не отражает истинных свойств природной воды. Поэтому в настоящей работе исследования выполнены на подземной воде Томского района, отобранной с глубины 80 м. В табл. 2 приведен химический состав исследуемой воды.
Химический состав и показатели исследуемой скважинной воды Таблица 2
|
Показатели |
Величина показателя |
ПДК по СанПиН 2.1.4.1074-01 |
|
рН |
6,8 |
6…9 |
|
Цветность, град |
16 |
20 |
|
Мутность, мг/л |
1,2 |
1,5 |
|
Железо общее, мг/л |
7,5 |
0,3 |
|
Марганец, мг/л |
0,18 |
0,1 |
|
Жесткость общая, 0Ж |
4,5 |
7,0 |
|
Гидрокарбонаты, мг/л |
280,0 |
Не норм. |
|
Кремний, мг/л |
9,2 |
10,0 |
|
Перманганатная окисляемость, мгО2/л |
1,6 |
5,0 |
|
Соотношение Са2+/Мg2+ |
4:1 |
|
Из табл.2 видно, что основным загрязняющим компонентом исследуемой скважинной воды является железо, которое содержится в виде двухвалентного иона, концентрация которого более чем в 20 раз превышает нормативные значения [4]. На рис.1 приведена зависимость окисления Fe(II) от времени (кривая 1) при контакте воды с кислородом воздуха в естественных условиях. Из рисунка видно, что переход Fe(II) в Fe(ОН)3 достигается после 8 часов контакта воды с кислородом воздуха, сопровождается формированием коллоидных частиц Fe(ОН)3, увеличением мутности воды, а затем коагуляцией, постепенным осаждением и осветлением раствора, рис. 1 (кривая 2). Длительные времена перехода железа Fe(II) в Fe(ОН)3 показывают проблему использования скважинных вод в бытовых целях без предварительной обработки.
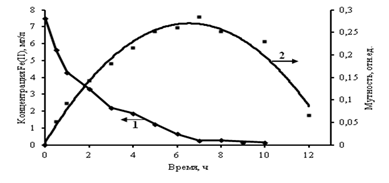
Рис.1. Зависимость изменения концентрации Fe(II) (1) и мутности воды (2) от времени контакта с кислородом воздуха
В первом методе исходную воду обрабатывали в электролизере с растворимым железным анодом, а во втором – в реакторе с импульсным электрическим разрядом в слое железных гранул. Эксперименты проводили в статическом режиме. При обработке воды в электролизере исследовали влияние плотности тока и различных концентраций коагулянта, наработанного в процессе растворения железного анода в течение 10 мин на изменение концентрации примесного железа в воде. На рис.2 (кривая 1) приведены результаты эффективности удаления железа при различных плотностях тока.
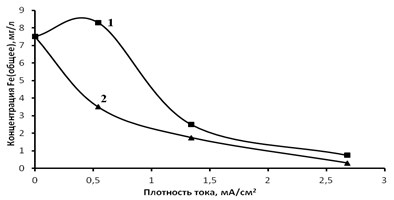
Рис.2. Зависимость изменения концентрации Feобщ.от плотности тока в электролизере без добавления коагулянта (1) и с добавлением коагулянта (2)
Из рис. 2 видно, что снижение концентрации железа в воде существенно зависит от плотности тока (кривая 1). Увеличение концентрации железа в растворе при малых плотностях тока происходит за счет электрохимического растворения анода. При этом концентрация наработанного железа недостаточна для начала процесса коагуляции.
С увеличением плотности тока происходит более быстрая наработка коагулянта, что приводит к процессу коагуляции и снижению концентрации общего железа в растворе. Увеличение плотности тока приводит к увеличению энергозатрат. Снижение энергозатрат возможно при дополнительном введении коагулянта и осуществлении процесса электрокоагуляции при низких плотностях тока. Для этого вводили дополнительное количество железного коагулянта равное 2,7 мг/л, полученного электрохимически. Результаты исследований иллюстрируются на рис.2 кривой 2. Сравнение кривых 1 и 2 на рис.2 показывает снижение концентрации железа в воде до нормативных значений при введении дополнительного количества коагулянта при более низких плотностях тока. На рис.3 показано изменение концентрации общего железа в воде при различных концентрациях коагулянта и наименьшей плотности тока равной 0,54 mA/см2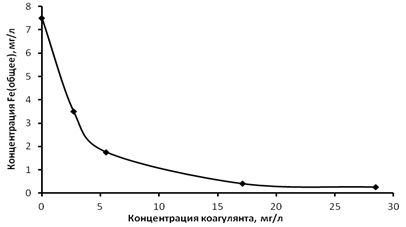
Рис. 3. Зависимость изменения концентрации Feобщ. от концентрации коагулянта, при постоянной плотности тока в электролизере равной 0,54 mA/см2
Из рис. 3 видно, что более высокие концентрации коагулянта приводят к достижению ПДК по железу при наименьшей плотности тока. Исходя из полученных зависимостей (рис. 2 и 3), а также детального анализа обработанной воды, механизм удаления железа может быть представлен в виде следующих стадий:
1) При растворении железного анода протекает реакция: ![]() (1)
(1)
Так как реакция протекает в водной среде, то часть железа у анода окисляется до 3-х валентного:![]() (2);
(2);
2) Второй этап коагуляции сводится к химическому процессу образования нерастворимых гидроксидов металлов, их кристаллизации с последующим формированием хлопьев, способных адсорбировать примеси из воды. Образование нерастворимых гидроксидов происходит в несколько этапов:
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
Процесс хлопьеобразования в электролизере протекает значительно интенсивнее, чем в камерах хлопьеобразования при реагентной коагуляции. Благоприятные условия электрокоагуляции позволяют уменьшить дозы металла, необходимые для очистки воды, в сравнении с дозами при реагентной коагуляции на 20 % и более [2].
Обработка воды по второму методу проводилась импульсными электрическими разрядами в электроразрядном реакторе с железной загрузкой. На рис. 4 показано изменение концентрации общего железа от времени воздействия ИЭР. Из рис. 4 видно, что концентрация общего железа в воде при действии импульсных электрических разрядов достигает нормативных значений за время менее 3 минут.
Механизм действия импульсного электрического разряда на воду в слое железной загрузки существенно отличается от механизма электрохимического воздействия в электролизере. В случае действия импульсов тока на металлические гранулы энергия импульса преимущественно воздействует на металл загрузки, происходит нагревание, эрозия и отрыв наноразмерных частиц металла от металлических гранул [1]. Одновременно импульсный электрический разряд действует и на воду с образованием химически активных частиц, таких как атомарный кислород и водород, возбужденные молекулы и радикалы.
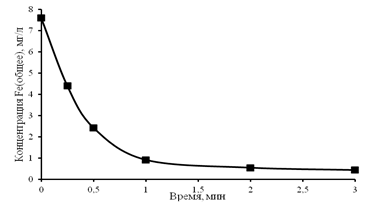
Рис. 4. Зависимость концентрации Feобщ. от времени обработки ИЭР
Основные стадии процесса можно представить следующей схемой (Feк – компактный металл, Feн – наночастицы металла):
![]() (6)
(6)
Feн + 2H2O ® Fe(OH)2 + H2 (7)
4Fe(OH)2 + O2 +2H2O ® 4Fe(OH)3 (8)
4Feн + 3O2 + 6H2O ® 4Fe(OH)3 (9)
В местах контакта электроразряда с гранулами локальная температура достигает свыше 2000 0С как за счёт энергии ИЭР, так и за счёт экзотермической реакции окисления. Продуктами эрозии железных гранул могут быть – Fe(OH)2, Fe(OH)3, FeO, Fe2O3, Fe3O4 и FeO(OH) с высокой окислительной способностью, сорбционной поверхностью и с сильно развитой коагулирующей структурой.
При реализации описанного механизма ИЭР в процессах очистки воды, содержащей повышенные концентрации ионов Fe2+, могут протекать следующие процессы [10]:
– высокотемпературный гидролиз ионов с образованием оксидов и гидроксидов;
– окисление гидроксидов растворенным кислородом (Fe(OH)2→Fe(OH)3;
– окисление Fe2+ продуктами разложения воды (OH·, O·).
Сравнение процессов окисления железа в исследуемой воде при обработке данными способами показало, что в случае электролизера время обработки составляет не менее 10 мин, а при действии ИЭР менее 3 мин. Электрофизические параметры используемых установок и эффективность удаления ионов железа позволили рассчитать энергозатраты используемых методов. Так, энергозатраты в электролизере составили 3 кВт.ч/м3, а при действии импульсного электрического разряда в слое металлических железных гранул – 0,5 кВт.ч/м3.
Заключение
Использование импульсного электрического разряда позволяет значительно снизить энергозатраты при удалении ионов железа из природных вод. Кроме того, достоинством данного метода является возможность использования в качестве металлической загрузки отходов металлообработки, а также получения высокодисперсных порошков в процессе диспергирования железных гранул с ценными физико-химическими свойствами, представляющими собой сырье для производства катализаторов, сорбентов, красителей, наполнителей, используемых в производстве керамики, кирпича, бетона и т.д.
Рецензенты:
Орлов Алексей Алексеевич, доктор технических наук, профессор кафедры технической физики Физико-технического института, г. Томск.
Косинцев Виктор Иванович, доктор технических наук, профессор-консультант кафедры общей химической технологии, Институт природных ресурсов, Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Национальный исследовательский Томский политехнический университет», г. Томск.



