Введение
Компьютерный анализ широко применяется в научно-исследовательских работах. В частности, достижения информатики, вычислительной техники, прикладной математики и статистики используются для решения проблем, поставленных биологией, в рамках раздела естествознания биоинформатики. Одним из наиболее важных направлений современной биоинформатики является разработка алгоритмов и программ для предсказания пространственной структуры белков. Гомологичное моделирование в настоящее время наиболее успешно и часто используется для решения этой задачи [3].
В настоящей работе предполагается использовать гомологичное моделирование для предсказания структуры флуоресцентных белков. Эти белки в последнее время стали широко использоваться при исследовании живых систем. В 2008 г. была присуждена Нобелевская премия по химии «За открытие и разработку зелёного флуоресцентного белка GFP». Такая популярность GFP (Green Fluorescent Protein, зеленый флуоресцентный белок) и родственных ему флуоресцентных белков возникла благодаря их способности к синтезу хромофора из собственных аминокислот без участия внешних кофакторов. Таким образом, цвет и физико-химические свойства определяются геном белка, что позволяет вводить флуоресцентные метки на генетическом уровне. В настоящее время разработано значительное количество генетически-кодируемых флуоресцентных зондов, биосенсоров и меток на основе флуоресцентных белков. При их разработке знание о структуре белка является одним из основополагающих.
Общая пространственная структура флуоресцентных белков
Все известные флуоресцентные белки с установленной кристаллической структурой имеют упаковку β-бочки (рис. 1), 11 β-листов образуют полый цилиндр с диаметром около 30 Å и длиной около 40 Å, внутри которого проходит сильно деформированная α-спираль, несущая хромофор. Небольшие α-спиральные участки находятся также на торцах цилиндра [5]. Хромофор, который и задает спектральные свойства белка, находится в середине и синтезируется автокаталитически из трех аминокислотных остатков самого белка (в GFP это остатки -Ser65-Tyr66-Gly67-).
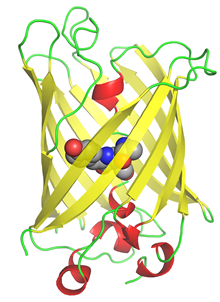
Рис. 1. Пространственная структура GFP (PDB ID: 1EMB). Хромофор внутри белка представлен в виде шаровой модели
Гомологичное моделирование белков повсеместно применяется для предсказания их структуры. Однако оно не применимо в исходном виде для флуоресцентных белков, содержащих в своей структуре хромофор. Структура этих белков в настоящее время определяется экспериментально при помощи рентгеноструктурного анализа. В то же время недавно было показано, что гомологичное моделирование в комбинации с масс-спектрометрическим анализом хромофорсодержащих пептидов флуоресцентных белков может быть использовано для предсказания их структуры [2]. Однако в некоторых случаях перед исследователем встает задача в оценке аминокислотного окружения хромофора, тогда как структура хромофора принципиального значения не имеет. Более того, структура хромофора относительно строго определяется цветовой группой, к которой он принадлежит. К примеру, все известные зелёные флуоресцентные белки содержат одинаковые хромофоры. Это же относится и к большинству красных белков. Всего известно менее 10 хромофоров, каждый из которых входит в определённую цветовую группу, причем часть из них может образовываться только из строго заданных хромофоробразующих аминокислотных последовательностей. Так, хромофор Kaede-типа образуется только из -His-Tyr-Gly- аминокислотной последовательности [1]. Некоторая информация о структуре хромофора может быть получена из спектральных свойств белка при денатурации в кислых и щелочных условиях [4]. Таким образом, данные о структуре хромофора могут быть с высокой вероятностью предсказаны на основании их спектральных свойств и хромофоробразующей последовательности аминокислот.
Применение программы Modeller для флуоресцентных белков
Для моделирования структуры флуоресцентных белков наиболее рациональным представляется использование программы Modeller, фактически, являющейся стандартом для гомологичного моделирования белков. Модель строится на основе аминокислотной последовательности белка и пространственной структуры другого, гомологичного белка, причём сходство последовательностей обычно должно быть не менее 30 %. Как правило, гомология флуоресцентных белков довольно высока и составляет 30–80 %, что и позволяет применять к ним Modeller (рис. 2).
10 20 30 40 50 60
GFP SKGEELFTGVVPILVELDGDVNGHKFSVSGEGEGDATYGKLTLKFICTTGKLPVPWPTLVTTF.VQCF
phiYFP SSGALLFHGKIPYVVEMEGNVDGHTFSIRGKGYGDASVGKVDAQFICTTGDVPVPWSTLVTTL.AQCF
* * ** * * ** * * ** ** * * *** ** ****** **** ***** * ***
70 80 90 100 110 120 130
GFP SRYPDHMKRHDFFKSAMPEGYVQERTIFFKDDGNYKTRAEVKFEGDTLVNRIELKGIDFKEDGNILGH
phiYFP AKYGPELK--DFYKSCMPEGYVQERTITFEGDGVFKTRAEVTFENGSVYNRVKLNGQGFKKDGHVLGK
* * ** ** *********** * ** ****** ** ** * * ** ** **
140 150 160 170 180 190 200
GFP KLEYNYNSHNVYIMADKQKNGIKVNFKIRHNIED--GSVQLADHYQQNTPIGDGPVLLPDNHYLSYQS
phiYFP NLEFNFTPHCLYIWGDQANHGLKSAFKIMHEITGSKEDFIVADHTQMNTPIGGGPVHVPEYHHITYHV
** * * ** * * * *** * * *** * ***** *** * * *
210 220
GFP ALSKDPNEKRDHMVLLEFVTAAGI
phiYFP TLSKDVTDHRDNMSLVETVRAVDC
**** ** * * * * *
Рис. 2. Выравнивание аминокислотных последовательностей белков GFP и phiYFP. Совпадающие аминокислоты обозначены звездочкой, хромофоробразующая последовательность – точкой. Степень гомологии между белками 51 %
При выравнивании аминокислотных последовательностей моделируемого белка и шаблона в ходе моделирования возможно несколько вариантов. Во-первых, можно оставить хромофоробразующую последовательность -X-Tyr-Gly- анализируемого белка немодифицированной. Очевидно, что в этом случае в смоделированной структуре конформации аминокислот в ближайшем окружении хромофора будут отличаться от таковых в нативном белке, так как геометрия -X-Tyr-Gly- трипептида существенно модифицируется при превращении в хромофор. Тем не менее данный подход может быть использован для генерации промежуточных состояний белка, которые трудно выявить при помощи кристаллографических исследований. Этот подход может быть использован при рассмотрении механизмов формирования хромофора и моделирования исходных состояний. Во втором варианте вместо хромофоробразующей триады можно использовать -Gly-Gly-Gly- последовательность. Поскольку глицин обладает высокой торсионной свободой, данная последовательность хорошо вписывается в полость хромофора. Данный подход вообще не учитывает структуру хромофора, однако позволяет оценить относительное расположение аминокислотных остатков вокруг него. В случае, если принципиально оценить взаимодействия аминокислотного окружения с хромофором, необходимо задать его структуру. Как было сказано выше, данные о структуре хромофора можно получить на основе спектральных свойств и последовательности аминокислот, из которых он синтезируется. Однако без проведения экспериментальных исследований нельзя сказать точно, насколько верна предложенная структура. С другой стороны, можно получить несколько моделей со всеми возможными для заданных параметров структурами хромофора. В данном случае при моделировании хромофор включается в последовательность белка в виде гетерогруппы на стадии выравнивания последовательностей. При этом программа переносит хромофор в созданную модель без модификаций как жёсткое тело.
В заключение в работе предложено несколько алгоритмов для получения модели пространственной структуры флуоресцентных белков. На основании полученных моделей можно оценить аминокислотное окружение хромофора, а также возможное расположение аминокислотных остатков в ходе синтеза хромофора.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации, соглашение № 8234.
Рецензенты:
Шуваева Т. М., д.х.н., в.н.с., Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова Российской академии наук, г. Москва.
Шахпаронов М. И., д.х.н., рук. группы, Федеральное государственное бюджетное учреждение науки Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова Российской академии наук, г. Москва.



