В последние годы отчетливо прослеживается тенденция к повышению частоты встречаемости гастродуоденальной патологии у детей, которая, по данным различных авторов, составляет 220-310 случаев на 1000 детей. Наиболее частой причиной гастродуоденальной патологии является хеликобактерная инфекция. В России уровень инфицированности детей H. рylori составляет 60-70% [1; 4]. Эпидемиологические исследования во Владивостоке, проводимые Кораблёвой Э.В. [3], показали высокую распространённость хеликобактерной инфекции - 548 случаев на 1000 детей, выявленных при проведении углубленных осмотров школьников. H. pylori присутствует более чем у половины людей во всем мире и является фактором риска развития язвенной болезни, аденокарциномы желудка и опухоли, развивающейся из лимфоидной ткани (MALT-лимфома) [9; 10].
Гастродуоденальные заболевания, ассоциированные с H. pylori, отличаются большим разнообразием морфологических и клинических проявлений. Вопрос о том, что определяет развитие той или иной формы заболевания, является наиболее сложным, и до настоящего времени не решен. Большинство исследователей высказывают предположение о ведущем значении внутривидового разнообразия штаммов H. рylori [4; 6].
В настоящее время ведутся активные исследования штаммов H. рylori, специфичных для развития конкретных гастродуоденальных заболеваний, ассоциированных с H. pylori [7]. Сообщения о роли различных штаммов в развитии гастродуоденальной патологии очень противоречивы. Все это не дает угаснуть научному интересу к данному микробу. Вследствие этого изучение особенностей различных по генетической структуре и вирулентности штаммов H. рylori, способных оказывать влияние на клиническое течение заболеваний, морфологических изменений слизистой оболочки желудка (СОЖ), а также эффективность терапии данной патологии является актуальной задачей современной медицины.
Целью и задачами данной работы явилось изучение частоты встречаемости различных генотипов H. рylori (таких как vacA и cagA) у детей с хроническими воспалительными заболеваниями верхних отделов пищеварительного тракта, у детей из семей с отягощенным анамнезом и у взрослых с раком желудка, а также их влияние на клинические и морфологические проявления.
Материалы и методы исследования
В основу работы вошли результаты обследования 135 детей в возрасте от 7 до 17 лет, поступивших на лечение в условиях дневного стационара КГБУЗ «Владивостокская больница № 3» с различными заболеваниями верхних отделов желудочно-кишечного тракта, и 40 взрослых пациентов с раком желудка. Все пациенты были разделены на три группы: первую составляли 115 детей с хроническими гастродуоденальными заболеваниями; вторую - 20 впервые обследовавшихся детей из семей с отягощенным анамнезом по раку желудка у близких родственников и имеющих в анамнезе хроническую патологию органов пищеварения; и третью группу - 40 пациентов с раком желудка.
Исследование было одобрено к проведению этическим комитетом ГБОУ ВПО «ВГМУ» Минздравсоцразвития России. Для постановки диагноза исследовали данные анамнеза, объективный осмотр, лабораторные и инструментальные исследования (эзофагогастродуоденофиброскопия с прицельной биопсией слизистой оболочки пораженного участка желудка). Верификацию диагноза проводили с использованием Сиднейской классификации (1996). Для идентификации H. рylori применяли быстрый уреазный тест ХЕЛПИЛ (ООО «АМА», Россия) в соответствии с инструкцией, а также постановку ПЦР. Для ПЦР использовали ДНК, выделенную набором «NucleoSpin Tissue» (Macherey-Nagel, Германия) из биоптатов антрального отдела желудка и опухолевой ткани. Амплификацию проводили в приборе «GeneAmp PCR system 2700» (Applied Biosystems, США) с праймерами для «гнёздной» ПЦР (табл. 1). Все реакции были выполнены с использованием GoTaq полимеразы (Promega, США). Режим амплификации для всех пар праймеров: 5 мин при 95 °С, 35 циклов - 20 с при 94 °С, 20 с при 55 °С, 30 с при 72 °С. Продукты амплификации 16S рДНК, а также генов vacAm и cagA H. рylori идентифицировали в 1,5%-ном агарозном геле, а vacAs - в 5%-ном полиакриламидном геле в присутствии бромистого этидия. Полученные в результате исследования медико-биологические данные обрабатывали в программе STATISTICA (версия 6).
Результаты исследования и их обсуждение
Выявление H. рylori 16S рДНК (маркер, который свидетельствует об инфицированности H. рylori) показало, что наиболее часто (85%) H. рylori обнаруживалась во II группе пациентов (дети из семей, где у родственников был диагностирован рак желудка) (табл. 1). В первой группе детей генетический материал Н. рylori обнаруживали у 53%, в то время как, по данным Мишкиной Т.В. и соавторов (2007), H. рylori обнаруживалась у 75,7% пациентов, что в 1,4 раза выше по сравнению с нашими данными. После тщательного изучения анамнеза выяснилось, что большинство пациентов этой группы получало антибактериальные препараты широкого спектра действия по поводу Н. рylori-инфекции, других заболеваний и осложнений после перенесенных ОРВИ. Для определения Н. рylori в третьей группе использовали послеоперационный материал, частота обнаружения 16S рДНК H. рylori составила 70%. В этой группе также перед операцией больные получали антибактериальные препараты с целью профилактики послеоперационных осложнений.
Таблица 1 - Обнаружение 16S rDNA Helicobacter pylori в обследуемых группах (абс. ч., Р±mp, %)
|
H. pylori |
I группа (n=115) |
II группа (n=20) |
III группа (n=40) |
|
H. pylori-позитивный |
61 53,0± 4,7 |
17**** 85,0±8,2 |
28* 70,0±7,3 |
|
H. pylori-негативный |
54 47,0±4,7 |
3 15,0±8,2 |
12 30,0±7,3 |
****р1 <0,001 - достоверность различий между I и II группами Н. рylori (+);
*р3 <0,05 - достоверность различий между I и III группами Н. рylori (+).
Одним из факторов патогенности H. pylori является ген vacA (vacuolating-associated cytotoxin). Продуктом этого гена является цитотоксин, выработка которого приводит к повреждению эпителиальных клеток СОЖ. Формирование пор в цитоплазматической мембране, увеличение проницаемости анионов через эти каналы и образование вакуолей внутри эпителиоцитов является свойством всех VacA-продуцирующих штаммов H. pylori [9]. В наших исследованиях среди 16S рДНК положительных образцов vacA обнаружен в 86,8% случаев. Возможно, это связано с небольшим количеством генетического материала H. pylori в некоторых образцах.
Оперон vacA обладает мозаичной структурой и содержит вариабельные части: s-регион (кодирующий сигнальный пептид) и m-регион (кодирующий средний участок зрелого белка). Описаны различные по размеру и нуклеотидной последовательности аллельные варианты этого гена: s1 или s2, и m1 или m2 соответственно. В нашем исследовании наиболее распространенным генотипом H. pylori был vacAs1, который одинаково часто встречался во всех исследуемых группах (60,6; 82,4; 82,1%), (табл. 2). При этом vacAs2 генотип встречался у 17,9% больных с хронической гастродуоденальной патологией, в 3,6% случаях в группе больных с раком желудка и только в сочетании с vacAs1 (микст-инфекция) в 17,6% случаев у детей из семей с отягощенной наследственностью по раку желудка. Доля смешанных генотипов (vacAs1/s2) в остальных группах составила 1,6% (группа I) и 3,6% (группа III). В то время как генотип H. pylori vacAm1 обнаруживали у 60,7% в III группе, 59,0% в I группе и 47,1% во II группе; а vacAm2 встречался во II группе - 47,1%, 45,9% - в I группе и в III группе - 25,0%. Во всех группах преобладающим являлся генотип H. pylori vacAs1.
Так же нами были проанализированы сочетания аллелей сигнального и среднего участков vacA гена (рис. 1). Генотип vacAs1m1 связывают с высокой цитотоксичностью [5]. В наших исследованиях vacAs1m1 встречался чаще (55,5%), чем остальные варианты. Наиболее редким генотипом был vacAs2m1 (2,2%).
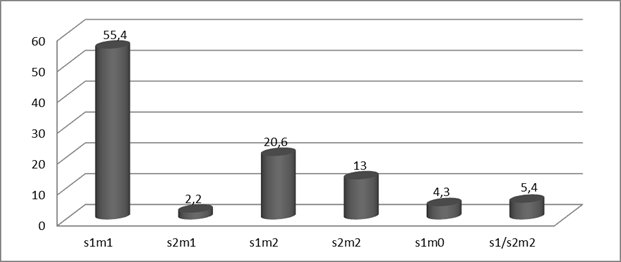
Рис. 1. Распределение вариантов генотипов vacA H. pylori.
Ген cagA (cytotoxin-associated gene), маркер острова патогенности (PAI), который кодирует белки IV секреторной системы H. pylori. Функция этой системы состоит в доставке эффекторных молекул в клетки макроорганизма. Они позволяют H. pylori модулировать метаболизм эпителиоцитов СОЖ, включая экспрессию протоонкогенов [8]. Инфицирование cagA-позитивными штаммами Н. рylori повышает риск развития воспалительного процесса в СОЖ [5]. Генотип сagA наиболее часто встречался у больных с раком желудка (71,4%, р <0,01) по сравнению с группой детей с гастродуоденальной патологией (34,4%).
Таблица 2 - Распределение генотипов vacA и cagA H. pylori в клинических группах, (абс. ч., Р ± mp, %)
|
Генотипы H. pylori |
I группа (дети с гастродуоденальной патологией) (N=61) |
II группа (дети из семей с раком желудка) (N=17) |
III группа(пациенты с раком желудка) (N=28) |
|
vacAs1 |
37* 60,6±6,6 |
14 82,4±9,2 |
23 82,1±7,2 |
|
vacAs2 |
12*** 17,9±4,7 |
0 0,0±0,0 |
1 3,6±3,5 |
|
vacAs1/s2 |
1 1,6±1,6 |
3 17,6±9,2 |
1 3,6±3,5 |
|
vacAm1
|
28** 45,9±6,4 |
8 47,1±12,1 |
17 60,7±9,3 |
|
vacAm2
|
20 32,8±1,1 |
8 47,1±12,1 |
7 25,0±8,2 |
|
cagA(+) |
21 34,4±6,1 |
10 58,8±11,9 |
20**** 71,4±8,5 |
|
cagA(-) |
40 65,6±6,1 |
7 41,2±11,9 |
8 28,6±8,5 |
*р1 <0,01 - достоверность различий между vacAs1 и s2 в первой группе;
**Р2 <0,01 - достоверность различий между vacAm1 и s1 в первой группе;
***Р3 <0,01 - достоверность различий между vacAs2 в первой и третьей группе;
****Р4 <0,01 - достоверность различий между cagA(+) в первой и третьей группе.
Характерной особенностью наших исследований было нахождение высокого процента встречаемости генотипа vacAs1 - 83%, что значительно отличается от данных, полученных в работе Маева И.В. (2004) [5], где обнаружение этого генотипа составило 63%, что в 1,3 раза реже, чем в наших исследованиях. В Татарстане, по данным Исаевой Г.Ш. и соавторов (2008) [2], этот показатель составлял 55,4%, что в 1,5 раза реже, по сравнению с нашими данными. Генотип H. pylori vacAs1 в Санкт-Петербурге, по данным Мишкиной Т.В. и соавторов (2007) [7], обнаруживали у детей с гастродуоденальной патологией только у 7,3%, что в 11,5 раз реже, чем в нашем регионе. Генотип cagA встречался в нашем регионе в 48,1%, что в 1,8 реже, чем в Москве (93%), и в 1,3 раза реже, чем в Татарстане (73,2%). В Санкт-Петербурге находили ген cagA - в 7,91%, что в 4,3 раза реже, чем в наших исследованиях. Эти различия обусловлены региональными особенностями циркулирующих популяций H. pylori.
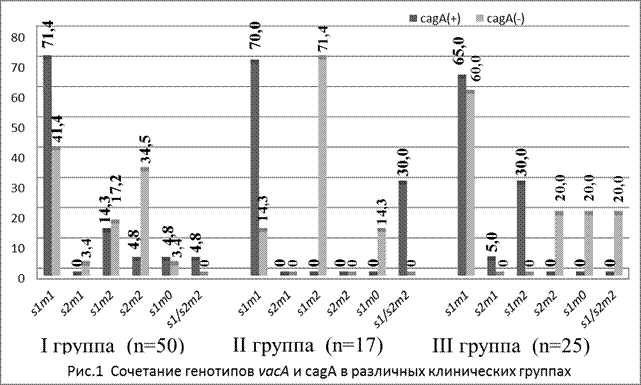
Известно, что между генотипами vacA и cagA Н. рylori существует взаимосвязь. Большинство vacAs1 штаммов являются cagA-позитивными и обладают наибольшей активностью к адгезии и внутриклеточной инфильтрации. Штаммы H. pylori, вырабатывающие активный белок VacA (s1 типа), как правило, содержат и cagA, а в штаммах, синтезирующих неактивные белки VacA (s2 типа), ген сagA обычно отсутствует [5; 10]. Встречаемость vacAs1cagA генотипа в нашем исследовании составила 71,4% в группе I; 70,0% - в группе II; 65,0% - в группе III (рис. 2). Это свидетельствует о высокой представленности данного генотипа в местной популяции H. pylori, а также о ее высоком вирулентном потенциале.
Выводы
- В данном исследовании достоверно чаще (р<0,001) выявляли хеликобактерную инфекцию у детей из семей с раком желудка (85%), и у больных с раком желудка (70%), чем у детей с гастродуоденальной патологией без отягощенной наследственности по раку желудка (53%). Это указывает на необходимость обязательного обследования на инфекцию H. pylori детей с отягощенным анамнезом.
- Наиболее распространенными генотипами vacA H. pylori были vacAs1, которые в большинстве случаев были cagA-позитивными.
- Во всех клинических группах наиболее частым генотипом Н. pylori был vacAs1m1 (55,4%).
- Ген vacAs2 встречался у детей с гастродуоденальной патологией, в то время как у детей с отягощенным анамнезом по раку желудка этот штамм встречался в виде микст-инфекции в сочетании с vacAs1, а у раковых больных - только в 3,6% случаев.
- Выявлены различия в распределении vacA и cagA генотипов Н. pylori в разных регионах России, что, возможно, свидетельствует о наличии региональных особенностей в циркуляции различных популяций этой бактерии.
Рецензенты:
- Осин А.Я., доктор медицинских наук, профессор кафедры факультетской педиатрии ГБОУ ВПО «ВГМУ» Минздравсоцразвития России, г. Владивосток.
- Ни А., доктор медицинских наук, доцент кафедры педиатрии ФПК и ППС, иммунологии и аллергологии ГБОУ ВПО «ВГМУ» Минздравсоцразвития России, г. Владивосток.



