С целью синтеза новых биологически активных соединений нами был осуществлен синтез 1-бензилпиримидин-2(1Н)-онов, содержащих в положении 4 в качестве заместителя ариламинный фрагмент. Синтез этих соединений был осуществлен в два этапа. Исходный 2,4-бис(триметил силил окси)пиримидин (1), который количественно образуется при кипя чении урацила в избытке гексаметилдисилазана (ГМДС) в соответствии с извест ной методикой [6], в кипящем растворе 1,2-дихлорэтна обраба тывали соответствующим бензибромидом, что вело к 1-бензил замещенным ура цилам 2 – 6, выход которых составил 65-80 %. Вторая стадия заключалась в обработке 1-бензилурацилов 2 – 6 избытком бензиламина и ГМДС в присутст вии каталитического количества п-толуол сульфо кислоты, что является модификацией известной методики [4]. Кипячение реакционной смеси вело к целевым 4-бензиламино производным 7 – 11, выход которых составил 53-60 % (Схема).
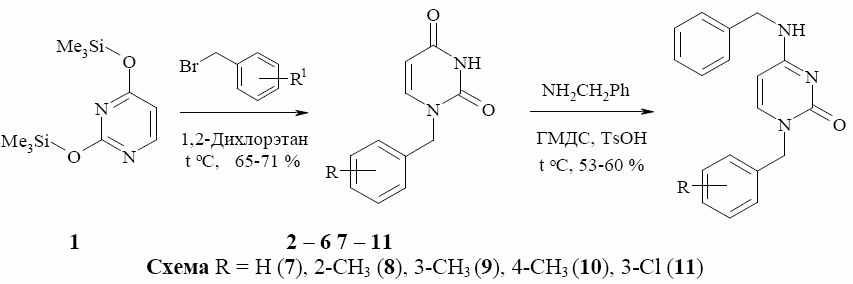
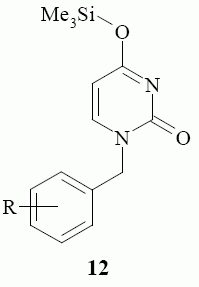
По всей вероятности, процесс аминирования протекает через стадию образования 4-(триметилсилилокси)пиримидин-2(1Н)-она 12, нуклеофиль ное замещение триметилсилилокси-группы которого бензиламином дает целевые 4-бензиламино производные 7 – 11. Следует отметить то, что триметил силилокси-группа занимает в пространстве значительный объем и оказывает существенное влияние на процесс замещения. Триметилсилил окси-группа экранирует атом углерода в положении 4 пиримидинового цикла, что значительно снижает скорость реакции. По этой причине реакция требует длительного нагревания.
Первичный скрининг наличия антибактериальной и противогриб ковой активности соединений 7 – 11 проводился в микробиологической лаборатории Волгоградского научно-исследовательского противочумного института (ВолгНИПЧИ).
Для оценки выраженности антибактериального действия на модельные микроорганизмы использовался ряд серийных разведений исследуемого вещества кратный концентрации 2 ´ 10-4 М.
Точную навеску исследуемого вещества растворяли в 1 мл димексида, при нагревании на водяной бане до полного растворения, полученный раствор затем без охлаждения тировали в горячем физиологическом растворе (pH = 7,0) до разведения, позволяющего получить конечную концентрацию 2 ´ 10-8 М в питательной среде. Полученные растворы добавляли соответственно в питательный агар Хоттингера, который разливали по 25 мл в чашки Петри [1, 2].
Чувствительность клеток микроорганизмов к исследуемым субстанциям оценивали путем высева микробной взвеси на контрольные и селективные плотные агаровые среды с последующим сравнением эффективности роста на них. Таким образом, осуществляли анализ устойчивости каждого модельного вида микроорганизма к действию химического агента [2].
Степень активности (в данном исследовании выраженная через величину МПК50 – минимальной подавляющей концентрации антибиотика (моль/л, мг/л или мкг/мл), которая in vitro подавляет видимый рост 50% исследованных штаммов) колеблется в зависимости от вида микроорганизма и свойств штаммов.
В исследовании были использованы стандартные штаммы из коллекции микроорганизмов ВолгНИПЧИ: Klebsiella pneumoniae 3, Escherihya coli K-12, Staphylococcus aureus 209, Pseudomonas aeruginose 4000, Salmonella paratyphi B 625, Candida albicans.
Из исходных штаммов методом серийных разведений готовили бактериальные суспензии с последующим высевом на агаровые пластинки со стандартной средой в дозе 100 м.кл. (микробных клеток). Посев проводили из 2-3-х разведений микробной взвеси на 3-4 чашки питательного агара из расчета не менее 60 колоний на каждой из них. Посевную дозу в 0,2 мл, содержащую 100-250 млн.кл., распределяли по агаровой поверхности раскатыванием. Через 24-48 часов инкубации при +37 ºС визуально оценивали результат путем подсчета изолированных колоний на поверхности агаровых пластинок [1, 2]. Все необходимые расчеты проводили, принимая за 100 % кон центра цию жизнеспособных клеток на контрольных средах [4]. Наличие димексида в питательной среде не оказывало влияния на рост микроорганизмов (по результатам контрольного опыта).
Исследуемые субстанции проявили различную противомикробную активность в отношении модельных штаммов микроорганизмов. Результаты исследований представлены в Таблице.
В исследовании выявлена высокая бактериостатическая активность 1-бензил-4-(бензиламино)пиримидин-2(1Н)-она (7) и 1-(3-хлорбензил)-4-(бензиламино)пиримидин-2(1Н)-она (11).
Для соединения 7 установлена высокая антибактериальная актив ность, МПК50 = 2 ´ 10-8 М в отношении модельных штаммов Staphylococcus aureus и Klebsiella pneumoniae. Кроме того, соединение 7проявило среднюю бактериостатическую активность в отношении штамма Pseudomonas aeruginosa, однако в данном случае оно оказалось менее эффективным и МПК50 превысила 2 ´ 10-8 М.
Добавление в питательную среду соединения 11 в концентрации 2 ´ 10-8 М снижало рост микробных клеток стафилококков в два раза, что является показателем наличия высокой антибактериальной активности. При этом выживаемость штаммов Klebsiella pneumoniae, E. coli, Salmonella typhimurium, Pseudomonas aeruginosa осталась прежней.
Для сравнения, МПК50 современного антибактериального препарата ципрофлоксацина для большинства штаммов Staphylococcus aureus составляет 0,5 мг/л [3].
Не установлено достоверно значимого влияния соединений 8, 9 и 10 на жизнеспособность исследуемых микроорганизмов.
Основываясь на полученных данных можно сделать вывод о том, что наличие в бензильном фрагменте метильных групп снижает активность соединений, а введение хлора в ароматическое кольцо, напротив, приводит к усилению анти-бактериальной активности. Таким образом, поиск соединений с антибактериальной активностью в ряду 1-бензилзамещенных 4-аминопиримидин-2(1Н)-онов является перспективным и актуальным.
Таблица 1. Чувствительность модельных микроорганизмов к некоторым полученным субстанциям
| Исследуемое вещество | Количество жизнеспособных клеток, % | |||||||||||||
| Escherichia coliK-12 | Salmonellatyphimurium B625 | Staphylococcusaureus 209 | Pseudomonas aeruginosa 4000 | Klebsiella pneumoniae 3 | Candida albicans | |||||||||
| Соединение | Mr | Навеска, мг | Контроль | Опыт | Контроль | Опыт | Контроль | Опыт | Контроль | Опыт | Контроль | Опыт | Контроль | Опыт |
| 7 | 341,818 | 72,84 | 100 | 86 | 100 | 78 | 100 | 53 | 100 | 68 | 100 | 55 | 100 | 93 |
| 8 | 307,378 | 76,35 | 100 | 85 | 100 | 92 | 100 | 98 | 100 | 94 | 100 | 92 | 100 | 98 |
| 9 | 307,378 | 76,35 | 100 | 99 | 100 | 87 | 100 | 99 | 100 | 88 | 100 | 88 | 100 | 93 |
| 10 | 307,378 | 76,35 | 100 | 94 | 100 | 96 | 100 | 96 | 100 | 89 | 100 | 87 | 100 | 99 |
| 11 | 321,408 | 81,45 | 100 | 91 | 100 | 93 | 100 | 50 | 100 | 92 | 100 | 92 | 100 | 89 |
Экспериментальная часть
Спектры ЯМР 1Н регистрировали на спектрометре Bruker DRX-500 (500 МГц) в ДМСО-D6, внутренний стандарт ТМС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3,0 фирмы Advanced Chemistry Development (Канада). Масс-спектры регистрировали на спектрометре Varian MAT-111 (прямой ввод, ионизация методом электронного удара, 70 эВ). ТСХ выполняли на пластинах Silufol UV-254, проявление в парах йода, элюент: хлороформ-метанол, 10 : 1. Температуры плавления измерены в стеклянных капиллярах на приборе Mel-Temp 3,0 (Laboratory Devices Inc., США).
Общая методика получения 1-бензилзамещенных урацилов 2 – 6. К раствору 0,244 моль толуола, ксилола или м-хлортолуола в 30 мл тетрахлорметана при кипении по каплям прибавляют раствор 2,2 мл (42,70 ммоль) брома в 10 мл тетрахлорметана. Растворитель упаривают при пониженном давлении, остаток прибавляют к раствору 9,95 г (38,40 ммоль) 2,4-бис(триметилсилилокси)пиримидина в 30 мл 1,2-дихлорэтана и полученную смесь кипятят 12 ч. Затем реакционную массу охлаждают до комнатной температуры, обрабатывают 10 мл этанола, выпавший осадок отфильтровывают, сушат и перекристаллизовывают из смеси ацетона-ДМФА (3 : 1).
1-Бензилурацил (2). Получают с выходом 70 % в виде белого мелкокристаллического вещества; Т.пл. 173-174 оС (169-170 ºС [5]) и Rf 0,47. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 4,78 с (2Н, СН2); 5,58 д (1H, J = 8 Гц, H-5); 6,98-7,24 м (5Н, ароматические Н); 7,66 д (1H, J = 8 Гц, H-6); 11,25 с (1Н, NH).
1-(2-Метилбензил)урацил (3). Получают с выходом 70% в виде мелко кристаллического продукта с желтоватым оттенком; Т.пл. 214-218 оС. Повторная кристаллизация из этанола дала белый мелкокрис таллический продукт с т.пл. 218-219 оС и Rf 0,53. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 2,16 c (3H, CH3); 4,79 с (2Н, СН2); 5,56 д (1H, J = 8 Гц, H-5); 6,88-7,14 м (4Н, ароматические Н); 7,63 д (1H, J = 8 Гц, H-6); 11,18 с (1Н, NH).
1-(3-Метилбензил)урацил (4). Получают с выходом 80 % в виде мелко кристал лического продукта с желтоватым оттенком; Т.пл. 146-150 оС. Повторная кристаллизация из этанола дала продукта в виде белых мелких пластинок с Т.пл. 149-151 оС и Rf 0,60. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 2,18 c (3H, CH3); 4,82 с (2Н, СН2); 5,57 д (1H, J = 8 Гц, H-5); 6,89-7,07 м (4Н, ароматические Н); 7,65 д (1H, J = 8 Гц, H-6); 11,09 с (1Н, NH).
1-(4-Метилбензил)урацил (5). Получают с выходом 71 % в виде мелко кристал лического продукта желтоватого цвета; Т.пл. 182-188 оС. Повторная кристаллизация из этанола дала продукт в виде белого мелкокристал лического вещества с Т.пл. 195-197 оС и Rf 0,47. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 2,19 c (3H, CH3); 4,80 с (2Н, СН2); 5,54 д (1H, J = 8 Гц, H-5); 6,90-7,11 м (4Н, ароматические Н); 7,60 д (1H, J = 8 Гц, H-6); 11,23 с (1Н, NH).
1-(3-Хлорбензил)урацил (6). Получают с выходом 65 % в виде белого мелкокристаллического вещества с Т.пл. 202-205 ºС и Rf 0,59. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 4,79 с (2Н, СН2); 5,57 д (1H, J = 8 Гц, H-5); 6,98-7,26 м (4Н, ароматические Н); 7,65 д (1H, J = 8 Гц, H-6); 11,26 с (1Н, NH).
Общая методика получения 1-бензил-4-(бензиламино)пирими дин-2(1Н)-онов 7 – 11. Смесь 14,79 ммоль 1-бензилурацила 2 – 6, 5,0 мл (45,77 ммоль) бензиламина и 30 мл ГМДС кипятят в присутствии каталитических количеств TsOH и NH4Cl в течение 32 ч, упаривают в вакууме, остаток растворяют в 20 мл этанола и выливают в 200 мл холодной воды. Полученную смесь помещают в холодильник на ночь. Выпавший осадок отфильтровывают, сушат и перекристаллизовывают из смеси ацетон-уксусная кислота (8 : 1).
1-Бензил-4-(бензиламино)пиримидин-2(1Н)-он (7). Получают с выходом 60 % вещества в виде белых блестящих мелких игольчатых кристаллов с Т.пл. 152-153 ºС и Rf 0,70. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 4,43 д (2Н, J = 5,7 Гц, NHСН2); 4,79 c (2H, NCH2); 5,73 д (1H, J = 7,5 Гц, H-5); 7,19-7,24 м (5Н, ароматические Н); 7,61 д (1H, J = 7,5 Гц, H-6); 8,04 т (1Н, J = 5,7 Гц, NH). Масс-спектр, m/z: 291 [M]+.
1-(2-Метилбензил)-4-(бензиламино)пиримидин-2(1Н)-он (8). По лу чают с выходом 53 % вещества в виде мелкокристаллического вещества белого цвета с Т.пл. 179-181 ºС и Rf 0,48. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 2,14 c (3H, CH3); 4,43 д (2Н, J = 6 Гц, NHСН2); 4,79 c (2H, NCH2); 5,75 д (1H, J = 7,5 Гц, H-5); 7,10-7,23 м (4Н, ароматические Н); 7,64 д (1H, J = 7,5 Гц, H-6); 8,04 т (1Н, J = 5,5 Гц, NH). Масс-спектр, m/z: 305 [M]+.
1-(3-Метилбензил)-4-(бензиламино)пиримидин-2(1Н)-он (9). По лучают с выходом 54 % вещества в виде мелкокристаллического вещества белого цвета с Т.пл. 162-164 ºС и Rf 0,51. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 2,16 c (3H, CH3); 4,42 д (2Н, J = 6 Гц, NHСН2); 4,76 c (2H, NCH2); 5,74 д (1H, J = 7,5 Гц, H-5); 7,11-7,17 м (4Н, ароматические Н); 7,64 д (1H, J = 7,5 Гц, H-6); 8,07 т (1Н, J = 5,5 Гц, NH). Масс-спектр, m/z: 305 [M]+.
1-(4-Метилбензил)-4-(бензиламино)пиримидин-2(1Н)-он (10). По лучают с выходом 53 % вещества в виде мелкокристаллического вещества белого цвета с Т.пл. 172-174 ºС и Rf 0,53. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 2,17 c (3H, CH3); 4,42 д (2Н, J = 6 Гц, NHСН2); 4,77 c (2H, NCH2); 5,73 д (1H, J = 7,5 Гц, H-5); 7,04-7,21 м (4Н, ароматические Н); 7,65 д (1H, J = 7,5 Гц, H-6); 8,07 т (1Н, J = 5,5 Гц, NH). Масс-спектр, m/z: 305 [M]+.
1-(3-Хлорбензил)-4-(бензиламино)пиримидин-2(1Н)-он (11). По лучают с выходом 59 % вещества в виде белых мелких кристаллов белого цвета с Т.пл. 192-194 ºС и Rf 0,57. Спектр 1Н ЯМР (ДМСО-D6), d, м.д.: 4,43 д (2Н, J = 6 Гц, NHСН2); 4,79 c (2H, NCH2); 5,75 д (1H, J = 7,5 Гц, H-5); 7,17-7,34 м (4Н, ароматические Н); 7,66 д (1H, J = 7,5 Гц, H-6); 8,08 т (1Н, J = 5,5 Гц, NH). Масс-спектр, m/z: 326 [M]+.
СПИСОК ЛИТЕРАТУРЫ:
1. Герхардт Ф. Методы общей бактериологии. – М.: Мир, 1983. – Т.1-3.
2. Пучков Е. О. Методы определения содержания и жизнеспособности микроорганизмов // Биотехнология. – 1988. – Т.4. - №1. – С.132 – 142.
3. Страчунский Л.С. , Дехнич А.В. , Белькова Ю.А. , группа исследователей проекта СтЭнт. Сравнительная активность антибактериальных препаратов, входящих в лекарственные формы для местного применения, в отношении Staphylococcus aureus: результаты российского многоцентрового исследования // Клиническая Микробиология и Антимикробная Химиотерапия. – 2002. – Т. 4. – № 2. – C.15
4. Форбрюгген Г. Триметилсиланол как уходящая группа в препаративной органической химии. В сб. «Современные направления в органическом синтеза» под ред. Нодзаки Х. – М.: Мир, 1986, C. 424-433.
5. Kundu N.G., Sikdar S., Hertzberg R.P., Schmitz S.A., Khatri S.G. Studies on uracil derivatives and analogues. Part 8. A non-catalytic method for the conversion of uracil derivatives into dihydrouracil derivatives. J. Chem. Soc. Perkin Trans. Pt. 1, 1985, P. 1295-1300.
6. Robins M.J., Hatfield P.W. Nucleic acid related compounds. 37. Convenient and high-yield synthesis of N-[(2-hydroxyethoxy)methyl]heterocycles as “acyclic nucleoside”analogues. Can. J. Chem., 1982, 60, N 5, P. 547-553.



