В последние годы обнаружена группа заболеваний, характеризующихся прогрессирующим поражением различных отделов нервной системы и имеющих необычный генетический механизм возникновения и развития. На основании сходства морфологического дефекта при этих заболеваниях их объединяют в группу спонгиоформных энцефалопатий [3]. Долгое время считалось, что клинические симптомы этих болезней возникают при попадании в организм инфекционного агента, имеющего антигенное сродство к нервным клеткам. Предполагалось, что в этом случае запускается механизм иммунного ответа, продолжающийся и после исчезновения из организма инфекционного агента, что приводит к образованию комплекса «антиген-антитело» и гибели нейронов [3].
Вскоре стало ясно, что основная патогенетическая роль в развитии этих заболеваний принадлежит белковому агенту, который было предложено называть прионом [1, 2]. В группу прионных болезней входят куру, болезнь Крейтцфельдта-Якоба (БКЯ), болезнь Герстмана-Штросслера и летальная семейная инсомния.
Одним из сложных вопросов является диагностика прионных заболеваний. За последние 20 лет разработан ряд методик для диагностики прионных инфекций, и все они, за редким исключением, рассчитаны на постмортальное исследование мозга. Основными современными методами диагностики прионной патологии остаются различные варианты иммунологического анализа, а именно: иммуногистохимическое (ИГХ) выявление аномальной формы приона на срезах тканей мозга, вестерн-блот и выявление фибриллярных структур губчатой энцефалопатии крупного рогатого скота, аналогичных скрепи-ассоциированным фибриллам [4].
Известные методы определения видовой принадлежности животных белков не всегда оказываются эффективными. Поэтому актуальной задачей является разработка молекулярно-генетических методов идентификации прионных болезней животных. Особый интерес в данном направлении представляет разработка тест-систем на основе полимеразной цепной реакции (ПЦР).
Важным фактором, определяющим эффективность ПЦР-метода идентификации прионных болезней животных, является способ консервирования биологической пробы (ДНК).
Консервирование при низких температурах (криоконсервирование) является самым распространенным и эффективным методом сохранения качества животного и растительного сырья. Известно, что охлаждение проб, содержащих нуклеиновые кислоты, до +4 °С может лишь приостановить процессы биодеградации. Для более длительного хранения используют низкие температуры от -20 °С до -195,8 °С, например, в условиях промышленных холодильных установок или в жидком азоте [6].
К недостаткам метода криоконсервации биологических проб следует отнести потенциальную возможность сохранения патогенных возбудителей вместе с образцом, необходимость постоянного поддержания бесперебойной работы холодильного оборудования и обязательной организации фиксации терморежимов хранения и бесперебойного энергоснабжения [6].
Возможна консервация ДНК-содержащих образцов этиловым спиртом, формалином или их сочетанием, которые обезвоживают ткани и обладают антимикробным, антиферментным и антиокислительным действием [7].
Известен способ хранения проб биологического происхождения методом FTA Gene Guard [5]. Метод FTA Gene Guard предполагает нанесение проб биологических жидкостей на фильтровальную бумагу, обработанную буфером, содержащим мощные денатурирующие вещества, которые также предотвращают рост бактерий и других микроорганизмов. Клеточные элементы биологической пробы на FTA-бумаге подвергаются лизису. ДНК высвобождается из ядер лейкоцитов и иммобилизуется на матриксе бумаги. Связанная таким образом ДНК может быть освобождена от гема или других ингибиторов ПЦР отмыванием, после чего FTA-бумага с иммобилизованной на ней ДНК может вводиться непосредственно в соответствующую амплификационную смесь.
Предложен метод консервирования проб для ПЦР-анализа, предполагающий инкапсулирование предварительно обезвоженных молекул ДНК в герметичную нержавеющую металлическую капсулу в атмосфере, состоящей из одного или нескольких инертных газов и имеющей степень влажности меньше или равную 1 млн-1 воды [5].
Эффективным является способ хранения биологического материала, заключающийся в следующем. После выделения и очистки образец ДНК в виде 100-500 мкл водного раствора наносят на обеззоленную фильтровальную бумагу, аккуратно промывают двойным объемом 96 %-го этанола. Полученные носители с ДНК в течение 30 минут подсушивают в термостате при температуре 50 °С и ламинируют, поместив последовательно между листами стандартной офисной бумаги (например, SVETOCOPY, плотностью 80 г/м2) и ламинатной пленкой (толщина 80-150 мкм). Предлагаемый способ прост в исполнении, имеет низкую себестоимость и при этом длительное время хранения, не влияет на качество иммобилизованной ДНК, что позволяет использовать такие препараты для методов молекулярно-генетического анализа, основанных на амплификации как митохондриальной, так и ядерной ДНК [5].
Цель исследования
Настоящее исследование направлено на изучение влияния условий хранения биологического образца на эффективность ПЦР-анализа при идентификации прионных болезней животных.
Материалы и методы исследования
Выделение ДНК из образцов осуществляли путем лизиса на основе гуанидинтиоционата с последующей нуклеосорбцией на магнитном силикагеле с использованием коммерческого набора реагентов «Magn S_DNA-uni» («Биоком», Москва). В состав коммерческого набора реагентов входят следующие растворы: лизирующий буфер ЛБ, отмывочный буфер ОБ, отмывочный буфер ОБ 2, буфер ТЕ, магнитный сорбент.
Схема выделения и очистки ДНК при помощи набора «Magn S_DNA-uni» представлена на рис. 1.
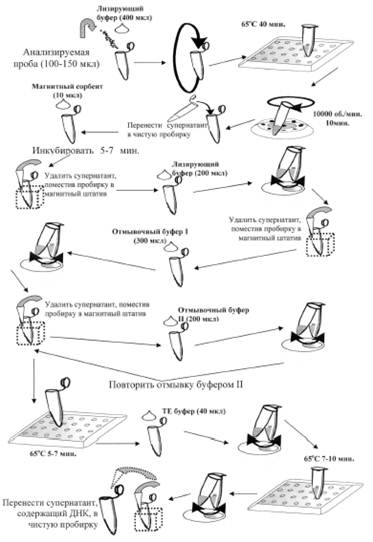
Рис. 1. Схема выделения и очистки ДНК при помощи набора «Magn S_DNA-uni»
Результаты исследования и их обсуждение
В настоящей работе исследовали влияние способа консервирования биологического образца (ДНК свиньи) на эффективность ранее разработанного ПЦР-метода идентификации прионных болезней животных. Были исследованы следующие способы консервирования:
- температура +4 °С;
- температура -20 °С;
- температура -195,8 °С;
- метод FTA Gene Guard;
- инкапсулирование обезвоженных молекул ДНК;
- нанесение водного раствора ДНК на обеззоленную фильтровальную бумагу.
Полученные результаты представлены в табл. 1.
Таблица 1 Влияние способа консервирования биологического образца на эффективность ПЦР метода
|
№, п/п |
Способ консервирования |
Количество исследованных проб |
Количество положительных проб |
% положительных проб от общего числа исследованных |
|
1 |
Температура +4 °С |
35 |
3 |
8,6 |
|
2 |
Температура -20 °С |
60 |
26 |
43,3 |
|
3 |
Температура -195,8°С |
55 |
21 |
38,2 |
|
4 |
Метод FTA Gene Guard |
70 |
54 |
77,1 |
|
5 |
Инкапсулирование обезвоженных молекул ДНК |
25 |
5 |
20,0 |
|
6 |
Нанесение водного раствора ДНК на обеззоленную фильтровальную бумагу |
40 |
24 |
60,0 |
Из табл.1 следует, что наиболее эффективными способами консервирования образцов ДНК свиньи являются метод FTA Gene Guard (77,1 % положительных проб от общего числа исследованных), нанесение водного раствора ДНК на обеззоленную фильтровальную бумагу (60,0 %) и замораживание до температуры -20 °С (43,3 %). Наименее предпочтительным способом консервирования является хранение при температуре +4 °С (8,6 %).
Далее с использованием разработанной ПЦР-тест-системы были протестированы пробы материала, взятого у свиней и хранившегося в течение 2-х недель методом FTA Gene Guard. Параметры ПЦР-анализа для исследования проб представлены в табл. 2.
Таблица 2 Компоненты полимеразной цепной реакции для исследования образца ДНК свиньи
|
Компонент |
Конечная концентрация |
Количество компонента на 50 мкл смеси |
|
1 |
2 |
3 |
|
10X ПЦР-буфер |
1X |
5 мкл |
|
10 мМ смесь дезоксинуклеотидтрифосфатов (дНТФ) |
0,2 мМ каждого |
1 мкл |
|
Праймер 1 (50 мкМ) |
1 мкМ |
1 мкл |
Продолжение таблицы 2
|
1 |
2 |
3 |
|
Праймер 2 (50 мкМ) |
1 мкМ |
1 мкл |
|
Taq-ДНК-полимераза |
1,25 ед. |
0,5 мкл |
|
25 мМ МgCl2 |
1-5 мМ |
2-5 мкл |
|
ДНК-матрица |
0,1-1 мкг |
Варьирует от концентрации образца |
|
Деионизированная вода |
- |
До 50 мкл |
Параметры амплификации представлены в табл. 3
Таблица 3 Параметры амплификации
|
Стадия |
Количество циклов |
Температура,°С |
Время инкубации |
|
|
Предварительная денатурация |
1 |
95 |
1 мин |
|
|
Денатурация |
30 |
95 |
30 с |
|
|
Отжиг |
56 |
1 мин |
||
|
Элонгация |
72 |
30 с |
||
Результаты, полученные в ходе эксперимента при исследовании материала ДНК свиньи, представлены в табл. 4.
Таблица 4
Результаты идентификации ДНК в исследуемом материале
№, п/п |
Наименование |
Длина ПЦР-ампликона, п.н. |
1 |
Положительный контроль |
153 |
2 |
Исследуемый образец |
- |
Таким образом, разработанная ПЦР-тест-система дает возможность проводить диагностику прионных болезней с высокой чувствительностью и надежностью.
Заключение
В работе исследованы шесть способов хранения биологического образца (ДНК свиньи) на эффективность ПЦР-анализа. Установлено, что наиболее эффективными способами консервирования образцов ДНК свиньи являются метод FTA Gene Guard (77,1 % положительных проб от общего числа исследованных), нанесение водного раствора ДНК на обеззоленную фильтровальную бумагу (60,0 %) и замораживание до температуры -20 °С (43,3 %). Наименее предпочтительным способом консервирования является хранение при температуре +4 °С (8,6 %).
*Работа выполнена в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007-2013 годы» (государственный контракт № 16.512.11.2077).
Рецензенты:
- Просеков Александр Юрьевич, доктор технических наук, профессор, проректор по НИР ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово.
- Майоров Александр Альбертович, доктор технических наук, профессор, директор ГНУ СибНИИС СО Россельхозакадемии, г. Барнаул.



