Рекомбинантные (химерные, гуманизированные или полностью человеческие) антитела относятся к активно развиваемому высокоэффективному сегменту фармацевтических препаратов биологического происхождения [5]. Возрастающая роль рекомбинантных антител в терапии онкологических, аутоиммунных, инфекционных заболеваний требует разработки производительных способов их биосинтеза в клеточных линиях млекопитающих. В фармацевтической индустрии задача производства терапевтических антител решается путем селекции стабильных клеточных линий-продуцентов и их адаптации к ферментации. Данный способ получения требует значительных временных и материальных затрат. Вместе с тем на этапе биоинженерной разработки антител возникает необходимость получения в короткие сроки в лабораторных условиях относительно небольших (20-50 миллиграмм) количеств белка с целью изучения его биологических свойств. В настоящей работе предложен ряд способов повышения продуктивности клеточной линии CHO DG44, экспрессирующей полноразмерные рекомбинантные антитела к фактору некроза опухолей-альфа (ФНО-альфа), при культивировании клеток в суспензии и в полимерных микрогранулах/микрокапсулах. Биосовместимые полимерные микрокапсулы для иммобилизации клеток животных были впервые предложены в начале 1980-х годов, и в настоящее время микрокапсулирование клеток широко применяется в биомедицине и биотехнологии [2, 3].
Цель исследования
Увеличение биосинтеза антител с помощью оптимизации условий культивирования клеточной линии CHO DG44 в суспензии, микрогранулах и микрокапсулах.
Материалы и методы
Для получения стабильной клеточной линии плазмидные вектора pOptiVEC-TOPO и pcDNA3.3-TOPO (Invitrogen, США) модифицировали превращением в кольцевые плазмиды посредством встраивания полилинкера, содержащего ряд сайтов рестрикции, часто используемых при клонировании. В каждый из полученных модифицированных векторов по отдельности клонировали гены тяжелой (Н) и легкой (L) цепей химерного антитела к ФНО-альфа, в результате чего были получены 4 экспрессионные плазмиды, pOptiVEC-L, pOptiVEC-H, pcDNA3.3-L, pcDNA3.3-H.
Трансфекцию клеток CHO DG44 осуществляли методом электропорации на приборе Amaxa® Nucleofector® II (Lonza, Великобритания) по методике, предложенной производителем, с использованием 5 мкг каждой из плазмидных конструкций. Селекцию продуцирующей линии проводили в 3 этапа. Первым этапом селекции было переведение культуры на среду OptiCHO, не содержащую гипоксантина и тимидина. Через 2 недели на втором этапе в среду OptiCHO добавляли антибиотик G418 (Invitrogen, США) в концентрации 500 мкг/мл. Продолжительность данного этапа селекции также составляла 2 недели. Третьим этапом было постепенное увеличение концентрации метотрексата (MTX) (УфаВИТА, Россия). Селекцию MTX начинали с минимальных концентраций MTX и увеличивали в 2 раза после прохождения предыдущего этапа и восстановления скорости удвоения популяции.
Уровень продукции антител оценивали с помощью метода непрямого иммуно-ферментного анализа с использованием рекомбинантного человеческого ФНО-альфа (ИБХ РАН) для сорбции.
Микрогранулы и микрокапсулы с иммобилизованными в них клетками получали в стерильных условиях по методике, описанной ранее [6]. Олигохитозан (ММ 3500, степень деацетилирования 89%) [1], полученный химической деструкцией коммерческого высокомолекулярного хитозана (ММ 1200 кДа, Sigma-Aldrich, Германия) был любезно предоставлен проф. А. Бартковиаком (Западнопомеранский университет, г. Щецин, Польша).
Аликвоты среды (500 мкл) собирали каждые 2 дня в течение 18 дней. Культуральную среду с микрокапсулами и микрогранулами, а также контрольную суспензионную культуру центрифугировали, после чего отбирали супернатант для проведения ИФА для оценки концентрации антител. Клетки обрабатывали трипановым синим для определения количества жизнеспособных клеток. Содержание живых клеток в микрокапсулах и микрогранулах определяли после механического их разрушения путем ресуспендирования через иглу шприца.
Результаты и обсуждение
Получение стабильной клеточной линии, производящей химерные антитела против ФНО-альфа, было осуществлено с использованием метода амплификации числа копий генов в дигидрофолат/метотрексатной системе [4]. Плазмиды pOptiVEC-L, pOptiVEC-H, pcDNA3.3-L и pcDNA3.3-H, содержащие гены легкой и тяжелой цепей химерного антитела к ФНО-альфа, были использованы для трансфекции суспензионной клеточной линии DG44 (dhfr-), производной линии CHO, не способной продуцировать дигидрофолатредуктазу. Для выяснения наиболее оптимального способа получения стабильной клеточной линии были использованы две комбинации плазмид, в результате чего были получены клеточные линии L1 и L2 (Таблица 1).
Таблица 1 .Стабильные клеточные линии для получения химерного антитела к ФНО-альфа
|
Клеточная линия |
Вектор, содержащий легкую цепь |
Вектор, содержащий тяжелую цепь |
|
L1 |
pcDNA3.3 |
pOptiVEC |
|
L2 |
pOptiVEC |
pcDNA3.3 |
Селекцию клеток проводили с помощью селективных агентов, гены устойчивости к которым имеются в плазмидных конструкциях. В результате анализа уровня продукции антител в линиях L1 и L2 на различных этапах селекции MTX был сделан выбор в пользу дальнейшего использования линии L2. Из сравнения данных, приведенных на рис. 1, следует, что продуктивность линии L2 превышает уровень продукции антител в линии L1.
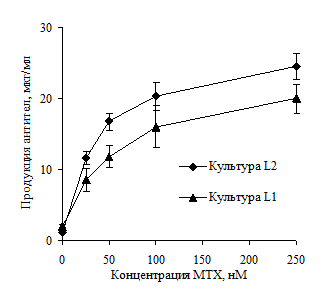
Рисунок 1. Продукция антител в клеточных линиях L1 и L2 в зависимости от концентрации метотрексата в среде культивирования.
В рамках оптимизации лабораторной технологии культивирования клеточных линий в суспензии было исследовано влияние плотности клеточного инокулята и режима культивирования на уровень продукции антител. Антитело-продуцирующую линию L2 выращивали в присутствии 250 нM MTX в качестве селектирующего агента. С целью выяснения оптимального метода культивирования в суспензии были использованы три основных подхода.
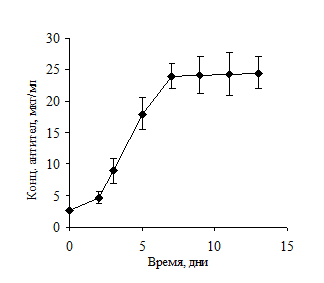
В методе «произвольного культивирования» клетки вносили в среду культивирования в минимальной необходимой концентрации 3×105 клеток/мл. Культивирование проводили без замены культуральной среды, при этом клетки росли без какого-либо вмешательства. Аликвоты отбирали каждые 48 часов. Концентрацию антител оценивали по результатам ИФА (рис. 2). При плотности культуры 3×106 клеток/мл рост прекращается и в дальнейшем плотность начинает снижаться. Это приводит к прекращению биосинтеза антител, в результате чего концентрация антител в среде остается на одном уровне.
 |
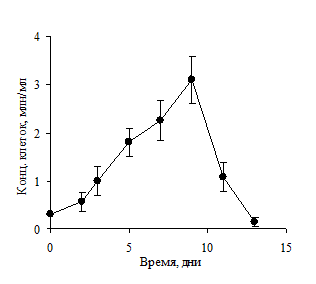 |
Рисунок 2. Уровень продукции антител (А) и количество живых клеток в культуре (Б) при произвольном культивировании клеток линии L2
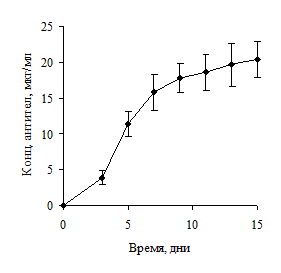
Принцип метода контролируемой плотности заключался в поддержании концентрации клеток в пределах, не допускающих контактного торможения культуры. Клетки вносили в культуральную среду в концентрации 6×105 клеток/мл. Клетки центрифугировались каждые 48 часов, после чего их вносили в ту же среду. Количество клеток поддерживалось в концентрации 6×105 клеток/мл. Данный подход позволял клеткам свободно делиться и поддерживать высокий уровень пролиферативной активности (рис. 3).
 |
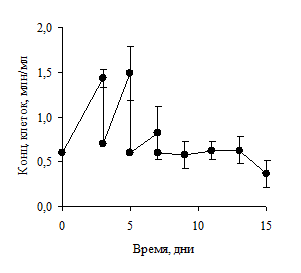 |
Рисунок 3. Уровень продукции антител (А) и количество живых клеток (Б) при контролируемом уровне плотности культуры
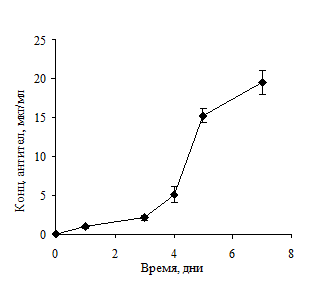
Метод сверхплотной инокуляции заключался в использовании высокой плотности инокулирования 4,5×106 клеток/мл. Культивирование производилось без замены питательной среды. В результате такого культивирования количество живых клеток в культуре постепенно снижалось, при этом продукция антител сохранялась на уровне культуры, выращиваемой методом контролируемой плотности, и была даже ниже, чем в культуре с произвольным культивированием (рис. 4).
 |
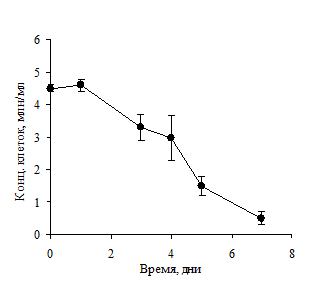 |
Рисунок 4. Уровень продукции антител (А) и количество живых клеток (Б) в культуре при высокой плотности инокулирования
Использование данного режима приводило к постепенному уменьшению плотности культуры и прекращению биосинтеза антител.
Наибольшие уровни экспрессии, которые наблюдали при использовании описанных методов культивирования, приведены в Таблице 2.
Таблица 2. Уровень продукции антител при различных методах культивирования в суспензии
|
Метод культивирования |
Концентрация антител в |
|
Метод произвольного культивирования |
24,5 ± 3 |
|
Метод контролируемой плотности |
20,4 ± 2,5 |
|
Метод сверхплотной инокуляции |
19,5 ± 1,5 |
Метод произвольного культивирования с низкой плотностью посева при произвольном культивировании позволил добиться наибольшего выхода биосинтеза антител.
Была также исследована возможность культивирования клеток стабильной клеточной линии в биосовместимых полупроницаемых полиэлектролитных микрокапсулах, а также изучена кинетика накопления антител в культуральной среде. Микрокапсулирование клеточной линии CHO L2 осуществляли путем приготовления 1.5 мл микрокапсул и 1.5 мл гранул на 30 мл среды, что соответствовало плотности 3 × 105 клеток/мл культуральной среды. В качестве контроля использовали суспензионную культуру CHO L2.
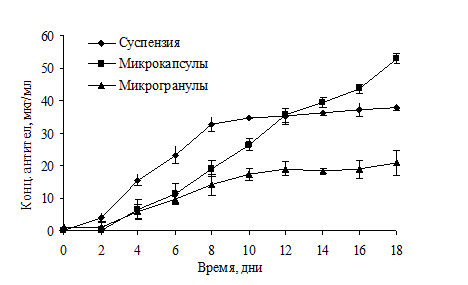
Сравнение уровня экспрессии антител в микрокапсулах, микрогранулах и в суспензии представлено на рис. 5.
 А
А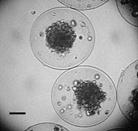
Б В
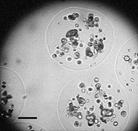
Рисунок 5. Культивирование CHO L2 в микрокапсулах, микрогранулах и суспензионной культуре: (А) продукция антител; (Б) изображения клеток на 14 день культивирования, растущих в CaAlg микрогранулах; (В) - в альгинат-олигохитозановых микрокапсулах. Шкала 100 мкм
Из рис. 5 можно сделать вывод о том, что культивирование стабильных антитело-продуцирующих линий в микрокапсулах приводило к увеличению продукции белка по сравнению с суспензионной культурой. В то время как кривая накопления антител в суспензионной культуре выходила на плато уже на 7 день культивирования при достижении максимально допустимой в суспензионной культуре концентрации клеток (порядка 4-5 млн/мл среды), клетки в микрокапсулах продолжали пролиферировать и продуцировать антитела. При этом количество антител, накапливающихся в среде культивирования, увеличивалось на протяжении всего эксперимента и достигало 55 мкг/мл на 18 день, что достоверно выше, чем в суспензионной культуре. В случае микрогранул также наблюдали постепенное накопление антител в среде, однако в меньших количествах, чем в случае культивирования клеток в микрокапсулах. Это можно объяснить наличием гелевой структуры микрогранул, которая ограничивала свободное деление клеток (рис. 5Б). При этом клетки могли расти и пролиферировать только внутри каналов гидрогеля, в то время как в микрокапсуле свободного объема для роста клеток было значительно больше (рис. 5В).
Заключение
Проведено сравнение нескольких методов инокулирования клеточной биомассы при суспензионном культивировании клеток CHO DG44, продуцирующих рекомбинантные антитела к ТНФ-альфа. Показано, что метод культивирования с низкой плотностью посева способствует достижению наибольшего уровня биосинтеза антител. Предложена альтернатива культивированию клеток в суспензии, которая представляет собой культивирование клеток в гидрогелевых микрогранулах на основе альгината кальция или в альгинат-олигохитозановых полупроницаемых микрокапсулах, мембрана которых позволяет антителам проходить через мембрану и накапливаться в культуральной среде. Показано, что уровень продукции антител клетками CHO DG44, включенными в полимерные микрокапсулы, превышала уровень продукции белка при суспензионном режиме культивирования.
Рецензенты:
- Румш Л.Д., д.х.н., профессор, заведующий лабораторией протеолитических ферментов Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, г. Москва.
- Еремин С.А., д.х.н., профессор, ведущий научный сотрудник, руководитель группы «Иммуноанализа» кафедры химической энзимологии, химический факультет МГУ им. М.В. Ломоносова, г. Москва.
Работа получена 01.11.2011.



