Известно, что цисплатин (цис-диаминдихлорплатина (2+)) (синонимы: платидиам, рlatidiam, рlatinol) медленно и очень малорастворим в воде и изотоническом растворе хлорида натрия. Плохая растворимость цисплатина и его высокая общая токсичность в сочетании с практически незаменимостью приводят к тому, что во всем мире предпринимаются попытки его химической модификации с целью снижения токсичности и повышения растворимости.
Одним из наиболее интересных способов получения модифицированного соединения является синтез цис-диаминдихлордигидроксоплатины (4+) из цис-диаминдихлорплатины (2+) путем обработки суспензии цисплатина 30%-ной перекисью водорода при 60-80 ºС с последующим отделением твердого остатка, не затрагивая стерического размещения хлор- и аминогрупп, что приводит к сохранению противоопухолевой активности. Другим синтетическим подходом к модификации цисплатина с целью создания его растворимой формы является создание комплекса с уже известным препаратом, который входит во внутреннюю координационную сферу цисплатина. Американский подход к модификации цисплатина заключается в синтезе новых соединений, где один из лигандов замещен на другой биогенный лиганд или аминокислоту с целью понижения общей токсичности цисплатина.
При использовании аминокислот в качестве лигандов учитывается свойство последних легко сополимеризоваться с широким классом мономеров. Кроме того, структура комплекса платины также должна способствовать более легкому и избирательному проникновению препарата в опухолевую клетку за счет димеризации и увеличения молекулярной массы соединения, поскольку известно, что транспорт макромолекулярных соединений в клетку осуществляется путем пиноцитоза, а опухолевые клетки, по сравнению с нормальными, обладают повышенной способностью к пиноцитозу.
Нами установлена возможность получения димерных комплексов платины (II) с мостиковыми аминокислотами посредством взаимодействия мономерных комплексных соединений цис-[Рt(NН3)2(L)2] (где L - анионы глицина (Gly), аланина (Ala), валина (Val)) с цис-диакводиаммином платины (II) [Рt(NН3)2(Н2О)2](NO3)2. В полученных соединениях аминокислота является мостиком между двумя центральными атомами платины. Полученные биядерные комплексы состава [(NH3)2Pt(μ-N,O-L)2Pt(NH3)2](NO3)2 охарактеризованы данными элементного анализа, методами криоскопии, кондуктометрии, ИК- и УФ-спектроскопии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез бисхелатных комплексов цис-[Pt(L)2]
Подробный синтез бисхелатных комплексов цис-[Pt(L)2] описан для глицина в [4], аланина в [3], валина в [5].
Навески GlyH (n = 0,009638 моль, m = 0,7229 г), AlaH (n = 0,009638 моль, m = 0,8578 г) или ValH (n = 0,009638 моль, m = 1,1335 г) растворяли при слабом нагревании в растворе КОН (n = 0,009638 моль, m = 0,5494 г), добавляли водный раствор K2[PtCl4] (n = 0,0024096 моль, m = 1 г) (мол. отношение 4:4:1), нагревали ~2 ч, отфильтровывали образовавшиеся через некоторое время осадки. Получали почти прозрачные фильтраты светло-желтого цвета, которые содержат анионы типа [PtL4]2- [2]:
K2[PtCl4] + 4LH + 4KOH → K2[PtL4] + 4H2O + 4KCl (1)
Для получения цис-[Pt(Gly)2], цис-[Pt(Ala)2] и цис-[Pt(Val)2] к основному раствору добавляли 1N HCl (n = 0,004819 моль, V = 4,8 см3) в соотношении 2 моля HCl на 1 моль исходного K2[PtCl4] и нагревали смесь на водяной бане ~2 ч. В этих условиях анионы [PtL4]2- превращаются в бисхелатные цис-[PtL2] [2]. В нашем случае получались осадки белого цвета, их отфильтровывали, промывали водой, спиртом, сушили при 100º С:
K2[PtL4] + 2HCl → [PtL2] + 2KCl + 2LH (2)
Выход бисхелатов колеблется в пределах 20-30%.
Найдено, %: Pt - 56,80; 56,74; 56,62; N - 8,08; 8,45; 8,36.
Для [Pt(Gly)2] вычислено, %: Pt - 56,85; N - 8,16.
Найдено, %: Pt - 56,80; 56,74; 56,62; N - 7,32; 7,19; 7,48.
Для [Pt(Ala)2] вычислено, %: Pt - 52,56; N - 7,55.
Найдено, %: Pt - 45,20; 45,87; 46,01; N - 6,91; 6,23; 6,41.
Для [Pt(Val)2] вычислено, %: Pt - 45,66; N - 6,55.
Синтез цис-[Pt(NH3)2(L)2]
Для размыкания хелатного цикла к 0,1 г цис-[Pt(L)2] приливали 3 см3 воды и 10 см3 концентрированного аммиака, полученную смесь нагревали до кипения. Через 30 мин кипячения наблюдали растворение осадка. Полученный раствор упаривали до минимального объема. После охлаждения из раствора выпадал осадок [Pt(NH3)2(L)2] в виде игольчатых кристаллов белого цвета. Осадок отфильтровывали, промывали минимальным количеством ледяной воды, спиртом, сушили при 100 ºС. Выход ~80%.
Найдено, %: Pt - 51,30; 51,48; 52,04; N - 15,12; 14,95; 14,73.
Для [Pt(NH3)2(Gly)2] вычислено, %: Pt - 51,72; N - 14,85.
Найдено, %: Pt - 48,35; 48,19; 48,51; N-13,95; 13,91; 13,74.
Для [Pt(NH3)2(Ala)2] вычислено, %: Pt - 48,15; N - 13,83.
Найдено, %: Pt - 42,80; 42,45; 41,88; N - 12,25; 11,98; 12,06.
Для [Pt(NH3)2(Val)2] вычислено, %: Pt - 42,30; N - 12,15.
Синтез цис-[Pt(NH3)2(H2O)2](NO3)2
цис-Диакводиаммин получали действием раствора AgNO3 на цис-Pt(NH3)2I2 из расчета 1,98 моль AgNO3 на 1 моль галогенсодержащего соединения, с последующим отделением галогенида серебра:
[Pt(NH3)2I2] + 2Ag(NO3) + 2H2O → [Pt(NH3)2(H2O)2](NO3)2 + 2AgI (3)
К навеске 1,16 г цис-Pt(NH3)2I2 в 20 см3 воды приливали 5 см3 водного раствора нитрата серебра (I), содержащего 0,757 г AgNO3. Раствор с осадком нагревали в течение 2 часов для коагуляции иодида серебра. После охлаждения осадок AgI отфильтровывали и получали прозрачный и бесцветный раствор [Pt(NH3)2(H2O)2](NO3)2.
Синтез цис-Pt(NH3)2I2 осуществляли согласно [9].
Синтез димерных комплексов [(NH3)2Pt(L)2Pt(NH3)2](NO3)2
Для синтеза димерных комплексов к растворам цис-[Pt(NH3)2(L)2] (m = 1 г в 5-10 см3 воды) приливали раствор цис-[Pt(NH3)2(H2O)2](NO3)2 (мол. отношение 1:1). Полученный раствор выдерживали при комнатной температуре в течение 24 часов. Наблюдали образование кристаллов. Кристаллы отделяли, промывали ацетоном и сушили в вакуум-эксикаторе до постоянной массы. Выход ~80%.
Найдено, %: Pt - 53,02; 53,33; 53,86; N - 14,86; 14,97; 15,20.
Для [Pt2(Gly)2(NH3)4](NO3)2 вычислено, %: Pt - 53,42; N - 15,34.
Найдено, %: Pt - 52,68; 51,89; 51,80; N - 14,24; 15,02; 14,43.
Для [Pt2(Ala)2(NH3)4](NO3)2 вычислено, %: Pt - 51,45; N - 14,78.
Найдено, %: Pt - 47,77; 47,50; 47,36; N - 10,17; 10,84; 9,98.
Для [Pt2(Val)2(NH3)4](NO3)2 вычислено, %: Pt - 47,90; N - 10,31.
УФ-спектры водных растворов комплексов (с = 1·10-4 моль/дм3) были получены на спектрофотометре СФ-46 в интервале длин волн 190-400 нм.
Молярная масса синтезированных димерных комплексов была определена криоскопическим методом в водном растворе.
Молярная электрическая проводимость водных растворов димерных комплексов (концентрация комплексов 1×10-4 моль/дм3) была определена на иономере-кондуктометре АНИОН 4145 при t = 25 ºС с использованием кондуктометрического первичного преобразователя - четырехэлектродной ячейки погружного типа, постоянная кондуктометрической ячейки равна 1 см-1.
ИК-спектры были сняты на ИК-спектрометре с Фурье-преобразователем TENSOR-27 (BRUNKER) в диапазоне 4000-400 см-1 с разрешением 4 см-1. Образцы готовили в виде таблеток с KBr.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При взаимодействии между мономерными комплексами платины (II) цис-[Pt(NH3)2(L)2] (L = Gly-; Ala; Val-) и нитратом цис-диакводиамминплатины (II):
цис-[Pt(NH3)2(L)2] + цис-[Pt(NH3)2(H2O)2](NO3)2 → [Pt2(L)2(NH3)4](NO3)2 + 2H2O (4)
молекула аминокислоты, связанная через атом азота аминогруппы с одним атомом платины, вытесняет молекулу воды, связанную с другим атомом платины, и становится мостиком между двумя атомами металла. Причем, если молекулы аминокислоты и воды в обоих реагирующих мономерных комплексах будут находиться в цис-положении, то в результате реакции образуется продукт с двумя мостиками.
Криоскопическим методом в водном растворе была определена молярная масса синтезированных димерных комплексов:
для [Pt2(Val)2(NH3)4](NO3)2 найденное значение 848, рассчитанное 814 г/моль;
для [Pt2(Ala)2(NH3)4](NO3)2 найденное значение 771, рассчитанное 758 г/моль;
для [Pt2(Gly)2(NH3)4](NO3)2 найденное значение 746, рассчитанное 730 г/моль.
Значения молярной электрической проводимости водных растворов димерных комплексов:
μ([Pt2(Gly)2(NH3)4](NO3)2) = 232 См·см2·моль-1,
μ([Pt2(Ala)2(NH3)4](NO3)2) = 187 См·см2·моль-1,
μ([Pt2(Val)2(NH3)4](NO3)2) = 180 См·см2·моль-1
характерны для электролитов, диссоциирующих на три иона, что косвенно подтверждает соответствие полученных соединений теоретическим формулам.
В области видимого спектра растворы комплексов не поглощают, а в УФ-области можно наблюдать относительно высокое поглощение. Характеристический максимум поглощения исследуемых комплексов лежит в интервале 200-240 нм (рис. 1, 2).
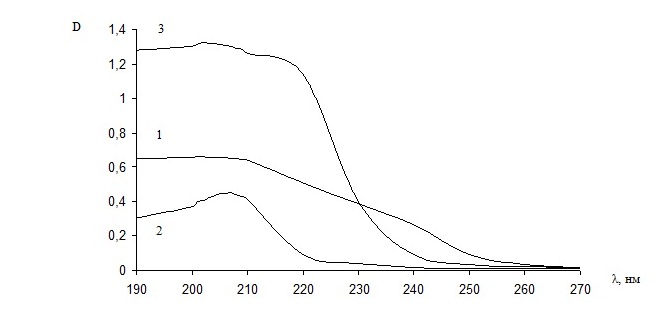
Рис. 1. УФ-спектры водных растворов комплексов Pt (II) с аланином:
1 - цис-[Pt(Ala)2];
2 - цис-[Pt(NH3)2(Ala)2];
3 - [Pt2(Ala)2(NH3)4](NO3)2.
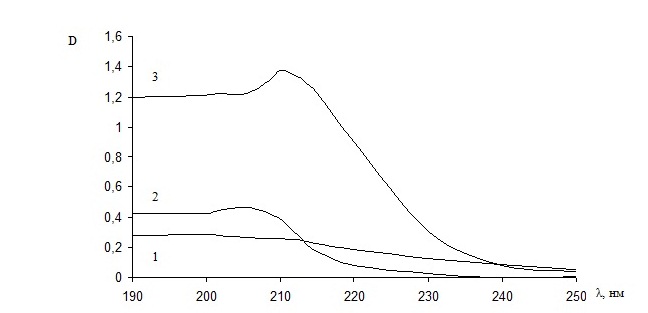
Рис. 2. УФ-спектры водных растворов комплексов Pt (II) с валином:
1 - цис-[Pt(Val)2];
2 - цис-[Pt(NH3)2(Val)2];
3 - [Pt2(Val)2(NH3)4](NO3)2.
В УФ-спектрах димерных комплексов присутствуют полосы поглощения, отличные от максимумов поглощения исходных мономерных комплексов (табл. 1).
Таблица 1 - Результаты УФ-спектроскопического исследования водных растворов комплексов (с = 1·10-4 моль/дм3)
|
Соединение |
λmax |
Dλ |
ελ |
|
[Pt(Ala)2] |
201 |
0,659 |
6,59·103 |
|
[Pt(Val)2] |
200 |
0,280 |
2,84·103 |
|
[Pt(NH3)2(Ala)2] |
207 |
0,450 |
4,50·103 |
|
[Pt(NH3)2(Val)2] |
205 |
0,464 |
4,64·103 |
|
[Pt2(Ala)2(NH3)4](NO3)2 |
202 |
1,322 |
13,22·103 |
|
[Pt2(Val)2(NH3)4](NO3)2 |
210 |
1,374 |
13,74·103 |
Интерпретацию ИК-спектров поглощения проводили на основании литературных данных по отнесению частот в ИК-спектрах родственных комплексов платины (II) с аминокислотами [1; 6; 8].
Волновые числа (см-1) максимумов характеристических полос поглощения в ИК-спектрах синтезированных мономерных и димерных комплексов представлены в таблице 2.
Таблица 2. - Волновые числа (см-1) максимумов характеристических полос поглощения в ИК-спектрах комплексов Pt(II) цис-конфигурации с аминокислотами
|
Соединение |
νas(N-H) |
νs(N-H) |
νas(COO-) |
νs(COO-) |
ν(Pt-N) |
|
Pt(Gly)2 |
3230 |
3090 |
1643 |
1374 |
|
|
Pt(NH3)2(Gly)2 |
|
|
1610 |
|
|
|
[Pt2(Gly)2(NH3)2](NO3)2 |
3229 |
3130 |
1637 |
1384 |
602; 503 |
|
Pt(Ala)2 |
3229 |
3098 |
1652 |
1384 |
610; 527 |
|
Pt(NH3)2(Ala)2 |
3195 |
3086 |
1604 |
1403 |
600; 515 |
|
[Pt2(Ala)2(NH3)4](NO3)2 |
3223 |
3122 |
1648 |
1386 |
604; 519 |
|
Pt(Val)2 |
3265 |
3100 |
1640 |
1370 |
|
|
Pt(NH3)2(Val)2 |
3196 |
3103 |
1612 |
1412 |
540; 520 |
|
[Pt2(Val)2(NH3)4](NO3)2 |
3283 |
3127 |
1634 |
1385 |
611; 515 |
Данные ИК-спектров мономерных и димерных комплексов подтверждают наличие координированной аминогруппы и ионизированной карбоксильной группы. Различия частот валентных колебаний связи N-H и C-O однозначно свидетельствуют о различных способах координации аминокислот: в мономерных комплексах [Pt(NH3)2(L)2] связь аминокислоты с платиной осуществляется только через атом азота, а в димерных и мономерных хелатных комплексах - через атомы азота аминогруппы и кислорода карбоксильной группы.
Область валентных колебаний связей N-H аминогруппы. Для некоординированной NH2-группы характерными являются две полосы поглощения в области 3500-3300 см-1. При координации с металлом происходит смещение данных полос в низкочастотную область 3200-3000 см-1. Свободные аминокислоты в цвиттер-ионной форме содержат группу NH3+, полоса поглощения которой лежит в области 3070-3170 см-1 [7].
В ИК-спектрах всех изученных соединений полосы, обусловленные асимметричными и симметричными валентными колебаниями NH2-группы аминокислоты, лежат в области 3220-3080 см-1. Наблюдаемый сдвиг ν(NH2) по сравнению с положением свободной NH2-группы указывает на координацию аминокислотных лигандов с атомом Pt(II) через атом азота.
Мостиковая координация аланина через атомы N и O в комплексе [Pt2(Ala)2(NH3)4](NO3)2 приводит к повышению νas(N-H) и νs(N-H) на 28 и 36 см-1 соответственно, по сравнению с положением этих полос в комплексе цис-[Pt(NH3)2(Ala)2], содержащего концевую N-координированную аминокислоту. Аналогичная картина наблюдается и для димерного комплекса с валином: νas(N-H) повысилась на 87 см-1, νs(N-H) - на 24 см-1 по сравнению с их положением в мономерном комплексе цис-[Pt(NH3)2(Val)2].
Область валентных колебаний карбоксильной группы. Полосы валентных колебаний депротонированной несвязанной карбоксильной группы обычно находятся около 1600 и 1400 см-1 (асимметричные и симметричные колебания соответственно) [8]. При координации депротонированной карбоксильной группы атомом платины частота асимметричного валентного колебания повышается до 1670-1620 см-1, в то время как частота симметричного валентного колебания понижается до 1370-1300 см-1 [8]. Протонированная несвязанная карбоксильная группа характеризуется полосой поглощения валентных колебаний связи С=О в области 1750-1700 см-1 [7]. В ИК-спектрах мономерных бисхелатных и димерных комплексов наблюдаются полосы поглощения в области 1652-1634 см-1 и 1386-1370 см-1. Это служит доказательством того, что карбоксильная группа аминокислотных лигандов в этих соединениях депротонирована и связана с атомом металла.
В мономерных комплексах, содержащих концевые N-координированные аминокислоты, наблюдаются полосы поглощения при 1612-1604 и 1412-1403 см-1. Можно сделать вывод, что карбоксильная группа аминокислотных лигандов в комплексах цис-[Pt(NH3)2(L)2] депротонирована и не связана с атомом металла. ИК-спектры комплексов платины (II) с аланином в области частот поглощения карбоксильной группы представлены на рисунке 3.
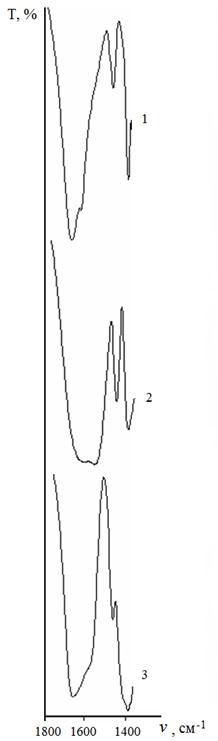
Рис. 3. ИК-спектры комплексов платины (II) с аланином в области частот поглощения карбоксильной группы:
1 - цис-[Pt(Ala)2];
2 - цис-[Pt(NH3)2(Ala)2];
3 - [Pt2(Ala)2(NH3)4](NO3)2.
Область валентных колебаний связей Pt-N.
Полосы валентных колебаний связи Pt-N лежат в пределах 608-502 см-1, и их смещение зависит от других лигандов в комплексе [1; 8].
При сопоставлении ИК-спектров пар соединений: мономерного комплекса [Pt(Ala)2] и [Pt2(Ala)2(NH3)4](NO3)2 обнаружено различие в положении полос ν(Pt-N). Так, для мономерного комплекса [Pt(Ala)2], в котором аланин координирован за счет атомов азота аминогруппы и кислорода карбоксильной группы и является концевым лигандом, ν(Pt-N) = 610 и 527 см-1.
Для димерного комплекса [Pt2(Ala)2(NH3)4](NO3)2, содержащего мостиковые N,O-координированные аминокислоты, значение ν(Pt-N) снижается до 604 и 519 см-1.
Работа выполнена при поддержке гранта губернатора Кемеровской области на проведение исследований молодыми учеными и кандидатами наук.
Рецензенты:
- Денисов В.Я., д.х.н., профессор, декан химического факультета, ФГБОУ ВПО «Кемеровский государственный университет», г. Кемерово.
- Черкасова Т.Г., д.х.н., профессор, декан химико-технологического факультета, ФГБОУ ВПО «Кузбасский государственный технический университет», г. Кемерово.
Работа получена 03.10.2011
ordm;С с последующим отделением твердого остатка, не затрагивая стерического размещения хлор- и аминогрупп, что приводит к сохранению противоопухолевой активности. Другим синтетическим подходом к модификации цисплатина с целью создания его растворимой формы является создание комплекса с уже известным препаратом, который входит во внутреннюю координационную сферу цисплатина. Американский подход к модификации цисплатина заключается в синтезе новых соединений, где один из лигандов замещен на другой биогенный лиганд или аминокислоту с целью понижения общей токсичности цисплатина.


