Одним из видов тяжелых гнойно-септических поражений мягких тканей являются тазово-подвздошные флегмоны или абсцессы. Они встречаются редко, но частота этой патологии ежегодно растет, а летальность в странах Европы и США составляет 16–19%, достигая 40% в слаборазвитых странах [1]. Это связано с быстрой генерализацией гнойно-септического процесса и частотой клинических проявлений сепсиса, который регистрируется в 62,5–77,6% наблюдений, при этом удельный вес тяжелого сепсиса составляет от 2% до 18% [2] с летальностью от 19% до 40–70% [3].
Адекватная антибактериальная терапия является одним из важнейших компонентов комплексного лечения подвздошно-тазовых флегмон. Ее адекватность во многом зависит от тактики антибактериального лечения и правильных представлений об актуальных возбудителях гнойно-септического процесса. В то же время в литературе, особенно отечественной, имеется недостаточное количество публикаций, в полной мере раскрывающих вопросы этиологии и лечения этой сложной патологии [4].
При первичных контаминациях, которые происходят лимфогенным или гематогенным путем, основными микроорганизмами, вызывающими гнойно-септический процесс, являются грамположительные кокки в виде S. aureus и E. сoli, которые выделяются в 42,9% и 14,3% наблюдений соответственно [5]. В то же время наличие иммунокомпрометации и снижение резистентности организма у этих больных приводят к тому, что создаются благоприятные условия для участия в инфекционном процессе микроорганизмов с низкой вирулентностью. В частности, в литературе описаны случаи развития подвздошно-тазовых флегмон, при которых выделялись Burkholderia cepacia [6], Nocardia farcinica [7], Mycobacterium avium, Salmonella enterica ssp., а также грибковая флора видов Candida и Actinomyces [8].
Имеется одно наблюдение острого илеопсоита, вызванного bacillus Calmette-Guérin, которая используется для лечения поверхностного рака мочевого пузыря путем внутрипузырного введения [9].
При контактном инфицировании тазово-подвздошной области частота выделения штаммов золотистого стафилококка снижается до 35,2%, так как качественный состав микрофлоры зависит от актуальных возбудителей первичного очага инфекции и характеризуется значительно большим полиморфизмом возбудителей. В основном золотистый стафилококк присутствует при контактном инфицировании из очагов костной деструкции при остеомиелитах тазовых костей или поясничных позвонков [10]. При инфицировании тазово-подвздошной области из брюшной полости, мочевыводящих путей и паранефральной клетчатки при наличии гнойного паранефрита чаще всего выделяются ассоциации микроорганизмов из грамотрицательных палочек семейства Enterobactericeae: E. coli в 42,1%, Enterococcus faecalis в 15,8% и бактероидов в 26% случаев, а у больных с туберкулезным поражением поясничных позвонков и костей таза выделяется микобактерия туберкулеза [11].
К сожалению, большинство публикаций носят описательный характер единичного клинического случая. Причинами выполнения настоящей работы послужили выраженный полиморфизм возбудителей и отсутствие системного подхода к выявлению этиологической структуры возникновения и развития тазово-подвздошных флегмон по данным литературы.
Цель: изучить качественный характер возбудителей флегмон тазово-подвздошной области и на основе полученных данных разработать оптимальные схемы эмпирической антибактериальной терапии.
Материалы и методы исследования. Нами изучены результаты бактериологических исследований у 103 больных с подвздошно-тазовыми флегмонами, находившихся на лечении в хирургических отделениях ГБУЗ КБСМП г. Краснодара с 2001 по 2020 гг. Мужчин было 84 (81,6%), женщин – 19 (18,4%). Средний возраст пациентов составил 43,9±4,7 года.
Для уточнения диагноза тазово-подвздошной флегмоны всем больным выполнялись обзорная рентгенография поясничного отдела позвоночника и тазовых костей, ультразвуковое исследование брюшной полости, КТ и МРТ подвздошно-тазовой области. Для ультразвукового исследования использовались аппараты Aloka 2500 и Toshiba Aplio 300 с конвексными мультичастотными датчиками 3,5–12 Mhz. Для проведения КТ использовались аппараты Philips Brilliance 64, Siemens SOMATOM Emotion 6 в режиме Pelvis W350 C35. Для выполнения МРТ использовался аппарат General Electric Brivo MR355 1,5 T по протоколам «Abdomen» или «Spine».
Выделение и культивирование микроорганизмов проводилось на базе бактериологической лаборатории МУЗ КГКБСМП по стандартным методикам (ФЗ № 323-ФЗ от 21.11.2011 г. «Об основах охраны здоровья граждан в Российской Федерации»), с учетом рекомендаций ВОЗ об уровнях приоритетности бактериальных патогенов и современных алгоритмов микробиологических исследований. Чувствительность микрофлоры к антибиотикам определялась диско-диффузионным методом Керри–Бауэра.
Культивирование анаэробной флоры не проводили в связи с высокой стоимостью и сложностью процесса исследования. Однако, учитывая то, что в процессе жизнедеятельности неклостридиальная анаэробная флора продуцирует ряд жирных кислот, таких как пропиленовая, валериановая, изопропиленовая, изовалериановая и некоторые другие, повышение концентрации жирных кислот в раневом отделяемом или в отделяемом по дренажам может служить достоверным (хотя и косвенным) признаком присутствия неклостридиальной анаэробной флоры в спектре возбудителей гнойно-септического процесса. Концентрацию жирных кислот в раневом отделяемом определяли методами газовой хроматографии с использованием газового хроматографа «Кристалл 200 М». Результаты обследования больных, включенных в исследования, фиксировались в разработанной нами интерактивной карте. Все числовые данные представлены в виде M±m. При условии сопоставимости объемов выборки и нормального распределения данных в группах наблюдения для оценки достоверности различий средних арифметических показателей проводился дисперсионный анализ с применением t-критерия Стьюдента. В случаях отсутствия нормального распределения данных в группах наблюдения проводился анализ с определением критерия Вилкоксона. Использовалась формула, разработанная для достаточно больших выборок в модификации Манна–Уитни. Для расчетов этих показателей применялся универсальный пакет «Statistica 10».
Результаты исследования и их обсуждение. Первичные гнойно-септические поражения выявлены у 24 (23,3%) больных. У этих пациентов не удалось определить конкретного контактного источника инфицирования. Поэтому считали, что гематогенный и лимфогенный пути распространения инфекции являлись наиболее вероятными механизмами попадания возбудителя в подвздошно-тазовые клетчаточные пространства и мышечные футляры. Вторичный путь (контактный) установлен в 79 наблюдениях (76,7%). Кроме того, все инфекционные процессы были разделены на поверхностные и глубокие.
Первичные поверхностные инфекции тазово-подвздошной области в 13 (12,6%) случаях были представлены аденофлегмонами тазово-подвздошной области. Среди первичных глубоких поражений диагностировано 11 (10,7%) первичных илеопсоитов, из них у 3 (2,9%) больных выявлена флегмона Brault, в 4 (3,9%) случаях имел место посттравматический илеопсоит, при этом двустороннее поражение было установлено в 3 (2,9%) наблюдениях.
Причиной развития вторичного поверхностного гнойно-воспалительного процесса в подвздошно-тазовой области в 9 (8,7%) наблюдениях служило восходящее распространение по подкожно-жировой клетчатке флегмоны верхней трети бедра у больных парентеральной наркоманией с постинъекционными осложнениями. В остальных 5 (4,9%) случаях инфекция распространялась нисходящим путем с переднебоковой стенки живота и поясничной области.
Вторичные глубокие гнойно-септические поражения тазово-подвздошной области характеризовались многообразием причин развития и механизмов инфицирования (табл.). При глубоких флегмонах верхней трети бедра у 26 (25,2%) пациентов гнойно-септический процесс распространялся в тазово-подвздошную область по ходу сосудистых пучков, у 8 (7,8%) больных с гнойным пиомиозитом верхней трети бедра – через треугольник Скарпа. Еще у 9 (8,7%) пациентов гнойный пиомиозит мышц верхней трети бедра стал причиной развития вторичного гнойного илеопсоита. Остеомиелит поясничных позвонков и костей таза вызвал развитие вторичного гнойного илеопсоита в 3 (2,9%) и 6 (5,8%) случаях соответственно. Кроме этого, причиной развития вторичного гнойного илеопсоита стала гангрена Фурнье у 4 (3,9%) пациентов.
Классификация причин развития вторичных тазово-подвздошных флегмон
|
Причины развития вторичных флегмон тазово-подвздошной области |
Вторичные n=79 (76,7%) |
Всего |
|
|
Поверхностные |
Глубокие |
||
|
Восходящие флегмоны из подкожной клетчатки в/3 бедра |
9 (8,7%) |
– |
9 (8,7%) |
|
Нисходящие флегмоны с передней брюшной стенки и поясничной области |
5 (4,9%) |
– |
5 (4,9%) |
|
Остеомиелит костей таза |
|
6 (5,8%) |
6 (5,8%) |
|
Остеомиелит поясн. позвонков |
|
3 (2,9%) |
3 (2,9%) |
|
Деструктивный аппендицит |
– |
1 (0,9%) |
1 (0,9%) |
|
Восходящая паравазальная флегмона |
– |
26 (25,2%) |
26 (25,2%) |
|
Восходящая флегмона через треугольник Скарпа |
– |
8 (7,8%)
|
8 (7,8%)
|
|
Гнойный пиомиозит в/3 бедра |
– |
9 (8,7%) |
9 (8,7%) |
|
Гангрена Фурнье |
– |
4 (3,9%) |
4 (3,9%) |
|
Туберкулез поясн. позвонков |
– |
2 (1,9%) |
2 (1,9%) |
|
Гидронефроз |
– |
2 (2,9%) |
2 (2,9%) |
|
Состояние после нефрэктомии |
– |
1 (1,9%) |
1 (1,9%) |
|
Нисходящие флегмоны из забрюшинной и паранефральной клетчатки |
– |
5 (4,9%) |
5 (4,9%) |
|
ИТОГО |
14 (13,6%) |
65 (63,1%) |
79 (76,7%) |
Кроме того, ко вторичным илеопсоитам были отнесены 3 (2,9%) случая гнойного воспаления пояснично-подвздошной мышцы у урологических больных, у 1 (0,9%) после нефрэктомии и еще у 2 (1,9%) – с инфицированным гидронефрозом на фоне нефролитиаза. В 5 (4,9%) наблюдениях имело место нисходящее инфицирование из очагов, расположенных в забрюшинной и паранефральной клетчатке.
При анализе результатов бактериологических исследований монокультура возбудителя выделена у 81 (78,6%) больного. В 22 (21,4%) случаях возбудители гнойно-септического процесса были представлены ассоциациями 2 или более микроорганизмов. Наиболее часто в монокультуре выделялся St. aureus – 43 (41,7%) штамма. Грамотрицательные палочки семейства Enterobactericae были выделены в 34 (29,1%) наблюдениях. Кроме того, в 4 (3,9%) случаях глубоких вторичных флегмон возбудитель был представлен штаммами Str. pyogenes. Ассоциативная флора у 22 (21,4%) больных выделялась в виде сочетаний E. coli + St. aureus – 16 (15,5%) случаев, St. Aureus + Ps. aeruginosa и St. Aureus + Klebsiella – по 3 (2,9%) случая.
У 19 (18,4%) больных из 24 (23,3%) пациентов с первичными флегмонами тазово-подвздошной области выделенная монокультура была представлена, в основном, штаммами St. Aureus – в 13 (12,6%) наблюдениях и грамотрицательными палочками семейства Enterobactericae в виде E. coli – 5 (4,9%) штаммов и Ent. faecalis – 1 (0,9%) штамм. Ассоциации микроорганизмов, выделенные у 5 больных, были представлены сочетаниями E. coli + St. aureus – 3 (2,9%) случаев, St. Aureus + Ps. aeruginosa и St. Aureus + Klebsiella pneumoniae – по 1 (0,9%) наблюдению.
Вторичные тазово-подвздошные флегмоны характеризовались более широким спектром возбудителей гнойно-септического процесса. У этих 79 (76,7%) пациентов в монокультуре также преобладали штаммы золотистого стафилококка – 30 (29,1%) наблюдений, но значительно увеличилось число грамотрицательных штаммов палочек семейства Enterobactericae – 28 (27,2%). У 4 (3,9%) пациентов возбудитель был представлен штаммами гемолитического стрептококка. Также отмечен рост числа ассоциаций в спектре возбудителей, которые выделялись у 17 (16,5%) больных и были представлены, в основном, в виде сочетаний E. сoli + St. aureus – в 13 (12,6%) наблюдениях, St. aureus+Ps. aeruginosa и St. aureus+Klebsiella pneumoniae – по 2 (1,9%) случая.
Всего в монокультуре и в ассоциациях было выделено 65 штаммов стафилококка и 50 штаммов грамотрицательных палочек семейства Enterobactericae. Среди выделенных стафилококков обнаружено 2 (3,1%) коагулазотрицательных штамма и 2 (3,1%) метициллинрезистентных штамма (MRSA). До недавнего времени МRSA рассматривался исключительно как нозокомиальный патоген, поэтому появление внебольничных штаммов MRSA является неблагоприятной тенденцией. Кроме того, MRSA вызывают наиболее тяжелые инфекционные поражения мягких тканей, а стратегия применения антибиотиков при MRSA-инфекциях до конца не изучена. Среди выделенных штаммов грамотрицательных палочек семейства Enterobactericae продукции бета-лактамаз расширенного спектра (БЛРС) не выявлено.
Результаты газовой хроматографии раневого отделяемого, полученного при пункции или при проведении хирургической обработки гнойно-септического очага, показали, что у 2 больных с поверхностными и у 23 пациентов с глубокими тазово-подвздошными флегмонами имело место значительное и достоверное (р˂0,01) увеличение концентрации масляной, уксусной и пропионовой кислот. Показатели концентрации жирных кислот в раневом отделяемом у этих пациентов составили в среднем 0,24±0,06 ммоль/л для уксусной кислоты (норма 0,1 ммоль/л), 0,029± 0,007 ммоль/л для масляной кислоты (норма 0,0002 ммоль/л) и 0,053±0,014 ммоль/л для пропионовой кислоты (норма 0,00012 ммоль/л). Полученные данные косвенно свидетельствуют о том, что в этих случаях в качестве возбудителя гнойно-септического процесса имеет место ассоциация аэробной и анаэробной флоры. Всего повышение концентраций жирных кислот в раневом отделяемом выявлено у 25 (24,3%) пациентов. С учетом этого можно предполагать увеличение количества больных с ассоциативной флорой с 22 (21,4%) до 47 (45,6%).
Выделенные штаммы стафилококков обладали наибольшей чувствительностью к цефалоспоринам 2-го и 3-го поколений, фторхинолонам, клиндамицину и защищенным пенициллинам (амоксициллин/клавулонат). Чувствительность стафилококков к аминогликозидам выявлялась не более чем в 50% наблюдений, при этом наибольшая чувствительность отмечена к амикацину, а наименьшая – к гентамицину (рис.).
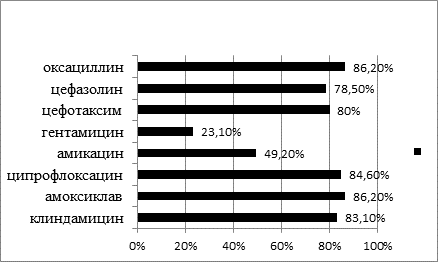
Чувствительность к антибиотикам выделенных штаммов стафилококка
Также установлена слабая чувствительность стафилококков к макролидам, среди которых наиболее высокой активностью обладает кларитромицин. У 2 обнаруженных метициллинрезистентных штаммов стафилококка выявлена устойчивость к антибиотикам группы тетрациклинов, макролидов и аминогликозидов. При этом сохранялась чувствительность к ванкомицину и ципрофлоксацину.
У выделенных штаммов грамотрицательных палочек семейства Enterobactericae наибольшая чувствительность была выявлена к левофлоксацину – в 43 (86%) случаях и цефалоспоринам 3-го поколения, в частности к цефтазидиму – в 42 (84%) наблюдениях. Кроме того, отмечено снижение чувствительности энтеробактерий и кишечной палочки к гентамицину, амикацину и цефалоспоринам 1–2-го поколений. Активность последних не превышала 30%.
У 4 (3,9%) больных возбудителем гнойно-септического процесса являлся Str. pyogenes. При исследовании установлена его достаточно высокая чувствительность ко всем видам β-лактамных антибиотиков. Штаммов Str. pyogenes, устойчивых к пенициллинам, цефалоспоринам и карбапенемам, не выявлено. В то же время в некоторых случаях отмечено наличие резистентности к макролидам и тетрациклину (75% чувствительных).
Выделенные штаммы синегнойной палочки отличались высоким уровнем резистентности к фторхинолонам и аминогликозидам и приемлемой чувствительностью к цефалоспоринам 3-го поколения.
С учетом полученных данных нами были подобраны схемы эмпирической антибактериальной терапии при гнойно-некротических поражениях нижних конечностей. Количественная и качественная составляющие антибиотикотерапии зависели от вида воспалительного процесса и глубины поражения мягких тканей. При относительно поверхностно расположенных первичных тазово-подвздошных флегмонах целесообразно применение ингибитор защищенных бета лактамов в виде амоксициллина/клавулоната или ампициллина/сульбактама в качестве эмпирической монотерапии или комбинации цефалоспоринов 3–4-го поколений с антианаэробными препаратами (клиндамицин или метронидазол). Подобные комбинации препаратов применяли и при нетяжелых вторичных инфекционных поражениях тазово-подвздошной области. Помимо этого, при наличии у пациента глубоких вторичных тазово-подвздошных флегмон препаратом первого ряда может являться ципрофлоксацин или левофлоксацин. С учетом высокой вероятности ассоциации с неклостридиальной анаэробной флорой схему лечения необходимо дополнять метронидазолом. У пациентов с тяжелыми инфекциями, признаками сепсиса и полиорганной недостаточности антибактериальная терапия должна носить деэскалационный характер и включать в себя применение карбапенемов. Включение в схемы антибактериальной терапии при лечении тазово-подвздошных флегмон препаратов групп аминогликозидов, тетрациклинов и макролидов мы считаем нецелесообразным.
Заключение. Многообразие клинических проявлений, выраженный полиморфизм и большая вероятность наличия ассоциаций возбудителей, в том числе и с неклостридиальной анаэробной флорой, а также важнейшая роль антибактериальной терапии в комплексе лечения диктуют необходимость постоянного мониторинга количественного и качественного состава актуальных возбудителей у больных с тазово-подвздошными флегмонами. Применение рациональных схем антибактериальной терапии позволит избежать возникновения перекрестной резистентности и улучшить результаты лечения этой тяжелой патологии.



