Проблема дефицита донорских органов и тканей диктует необходимость развития направлений, связанных с созданием их искусственных эквивалентов. На сегодня тканевая инженерия занимает одно из ведущих мест в регенеративной медицине и может рассматриваться в качестве альтернативы аллотрансплантации, в том числе и при кератопластике.
Нерешенные вопросы донорства, наряду с возрастающей потребностью в донорских органах и тканях, заставляют обратить внимание на децеллюляризацию как на перспективный метод получения биологических каркасов, последующая рецеллюляризация которых собственными стволовыми клетками реципиента позволит полностью восстановить структуру и функцию органа и/или ткани [1; 2]. Другим не менее перспективным направлением является использование амниотической мембраны, так, в недавнем исследовании была показана возможность применения конструкции на основе амниотической мембраны в качестве лечения тотального фиброваскулярного паннуса роговицы [3]. Островский Д.С. с соавт., используя методы тканевой инженерии, активно занимаются разработкой и созданием искусственной роговицы человека на основе полимерных материалов [4].
Децеллюляризация органов, то есть получение лишенного клеток межклеточного матрикса за счет перфузии с растворами детергентов, является одной из новых технологий в регенеративной медицине. Стоит отметить, что целью данного метода является сохранение состава, архитектуры и биологической активности межклеточного матрикса при полном удалении клеток и клеточных компонентов, что позволяет уменьшить риск отторжения тканей [5].
Операция под брендовым названием ReLEx SMILE является последним техническим достижением в рефракционной хирургии роговицы. В ходе данной операции с помощью фемтосекундного лазера внутри стромы роговицы формируется дискообразная лентикула, которая извлекается через небольшой разрез. Полученная в ходе операции лентикула остается невостребованной, вместе с тем было показано, что повторная имплантация роговичной лентикулы не только восстанавливает объем стромы роговицы, но и восстанавливает показатели аномалии рефракции после операции, как было продемонстрировано на моделях кроликов и обезьян [6; 7]. Также существуют сообщения о коррекции гиперметропии и кератоконуса с помощью имплантации интрастромальных лентикул [8-10].
В связи с вышеизложенным разработка методики децеллюляризации роговичной лентикулы представляется крайне актуальной.
В литературе существуют различные протоколы децеллюляризации, включающие в себя физические, химические и ферментативные методы [11]. Shafiq с соавт. в своей работе проводили сравнение различных протоколов децеллюляризации на цельных роговицах человека [12]. Согласно выводам авторов, децеллюляризация роговицы с использованием Тритон-X 100, полиэтиленгликоля и жидкого азота не приводит к полному удалению клеточного материала. Ацеллюлярный матрикс можно получить, используя протокол с додецилсульфатом натрия (SDS) и хлоридом натрия с нуклеазами. Данный протокол с натрия хлоридом и нуклеазами, как наиболее эффективный для рецеллюляризации стволовыми клетками, был заимствован китайскими учеными и успешно применен для получения ацеллюлярных стромальных лентикул в экспериментальной работе на животных [13].
Сингапурские ученые обрабатывали стромальные лентикулы изолированными растворами SDS, Тритон Х-100, хлоридом натрия и их комбинациями с нуклеазами в разной концентрации [14].
Таким образом, в описанной литературе применение различных протоколов децеллюляризации лентикулы роговицы человека носит противоречивый характер, и единого стандартизованного протокола не существует.
Целью данной работы был поиск эффективного протокола децеллюляризации роговичной лентикулы с сохранением ее уникальных морфофункциональных характеристик.
Материал и методы исследования
Донорские лентикулы были получены при выполнении операции ReLEx SMILE.
Для использования лентикулы перед операцией у пациентов было получено добровольное информированное согласие. Средний возраст пациентов составлял 28,5±5,8 года. Всем пациентам была выполнена операция SMILE по поводу миопии высокой степени и сложного миопического астигматизма (цилиндр до -0,75 дптр). Сферический эквивалент до операции SMILE составлял -6,93±0,63 дптр. Для методов децеллюляризации использовали лентикулы с толщиной 121-148 мкм и диаметром 6,5 мм.
Забор материала проходил в операционной на базе головной организации ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава РФ. Операция по технологии ReLex SMILE проходила под местной капельной анестезией, с помощью фемтосекундного лазера VisuMax (частота следования импульсов 500 кГц, энергия в импульсе 160 нДж), формировались сначала дно лентикулы, а затем ее «крышка». Диаметр лентикулы составлял 6.5 мм, а диаметр крышки 7.5 мм. Лентикула переносилась во флакон, содержащий дисперсный вискоэластик (ДВ) массой 600.000 Дальтон, в состав которого входили 3,0% гиалуронат натрия 4,0% и хондроитин сульфат. Флакон с лентикулой помещался в специальный контейнер с гипотермическим режимом. Затем контейнер с образцами транспортировался на базу Центра фундаментальных и прикладных медико-биологических проблем головной организации МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова. Дальнейшая работа выполнялась in vitro, в стерильных условиях (n= 30).
Децеллюляризация лентикулы. Для процесса децеллюляризации использовали два варианта растворов, которые различались по компонентам, концентрации и времени экспозиции. Таким образом, было сформировано три группы, где одна группа была контрольной, а две группы были опытными (таблица).
|
№ |
Действующие компоненты |
Описание методики |
|
1-я группа, контрольная |
Нативные лентикулы, n = 30 |
|
|
2-я группа, опытная |
1,5 М NaCl + ДНКаза 5 Ед/мл и РНКаза 5 Ед/мл (NaCl) n = 15 |
Инкубация в 1,5 М растворе хлорида натрия в течение 48 часов, с заменой раствора каждые 24 часа Затем образцы инкубировали в растворе с ДНКазой 5 Ед/мл (Sigma-Aldrich) и РНКазой 5 Ед/мл (Sigma-Aldrich) в течение 48 часов. Далее образцы промывали в растворе PBS в течение 72 часов, с заменой каждые 24 часа. Процедура обработки проводилась при комнатной температуре и при непрерывном встряхивании в шейкере |
|
3-я группа, опытная |
0,25% Трипсин-ЭДТА + гипотонический трис-буферный раствор (pH 7.2) + ДНКаза 50 Ед/мл и РНКаза 1 Ед/мл + гипотонический трис-буферный раствор, pH 7.2 (Трипсин-ЭДТА) n = 15 |
Инкубация в растворе 0,25% Трипсин-ЭДТА в течение 48 часов. Затем 1 час в гипотоническом растворе трис-буфера (pH 7.2). Далее в растворе с ДНКазой 50 Ед/мл и РНКазой 1 Ед/мл в течение 24 часов. В конце образцы отмывали в гипотоническом трис-буферном растворе (pH 7.2) в течение 1 часа. Процедура обработки проводилась при температуре 37 °C и при непрерывном встряхивании в шейкере |
Прозрачные свойства лентикулы
Спектральное пропускание лентикулы в диапазоне длины волн от 380 до 780 нм определяли с помощью спектрофотометра Multiskan GO (Thermo Scientific, США), данные собирались с шагом 10 нм. С целью дегидратации образцы обезвоживали в течение 1 часа в ДВ, далее их переносили в лунки 96-луночного планшета для измерения коэффициента пропускания  (%). Для статистического анализа данных в качестве расчетного значения применяли суммарное среднее для всей группы по 41 точке прозрачности полученного спектра.
(%). Для статистического анализа данных в качестве расчетного значения применяли суммарное среднее для всей группы по 41 точке прозрачности полученного спектра.
Для этого сначала был рассчитан 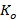 , следующим образом:
, следующим образом:
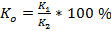 ,
,
где 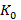 – коэффициент пропускания для каждой из 41 точек спектра в пределах одного образца в группе;
– коэффициент пропускания для каждой из 41 точек спектра в пределах одного образца в группе;
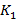 - коэффициент пропускания в лунке, содержащей образец;
- коэффициент пропускания в лунке, содержащей образец;
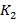 - коэффициент пропускания в лунке, не содержащей образец.
- коэффициент пропускания в лунке, не содержащей образец.
Затем был рассчитан 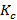 следующим образом:
следующим образом:
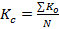 ,
,
где 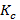 – средний коэффициент пропускания для каждой из 41 точек спектра всех образцов в группе;
– средний коэффициент пропускания для каждой из 41 точек спектра всех образцов в группе;
∑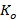 – суммарное значение измерений каждого образца в группе;
– суммарное значение измерений каждого образца в группе;
N = общее количество образцов в группе.
Далее был рассчитан 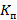 следующим образом:
следующим образом:
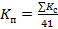 ,
,
где 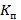 – коэффициент пропускания для всех точек спектра группы в целом (41 точка);
– коэффициент пропускания для всех точек спектра группы в целом (41 точка);
∑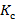 – суммарное значение среднего коэффициента пропускания;
– суммарное значение среднего коэффициента пропускания;
41 - общее количество точек спектра.
Гистологическая оценка нативных и децеллюляризированных лентикул
Материал фиксировали в 10% растворе нейтрального формалина, промывали проточной водой, обезвоживали в спиртах восходящей концентрации и заливали в парафин, выполняли серии гистологических срезов толщиной 2-3 мкм с применением окрасок гематоксилином-эозином. Препараты изучали на инвертированном микроскопе «ix81 Olympus» при 40-кратном увеличении с последующим фотографированием.
Количественное определение ДНК
Для измерения содержания ДНК было использовано по 10 образцов из каждой группы. Для выделения ДНК использовался набор DNeasy Blood & Tissue Kit (QIAGEN, Германия) в соответствии с рекомендациями производителя. Подсчет содержания ДНК осуществлялся с помощью флуориметра Qubit 2.0 (Invitrogen, США) и набора для анализа Qubit dsDNA HS (High-Sensitivity) Assay Kit (Invitrogen, США). Процедура измерения производилась согласно инструкции производителя.
Статистическую обработку полученных данных проводили с использованием среды для статистических вычислений R версии 4.0.2. (R Foundation for Statistical Computing, Вена, Австрия), а визуализацию данных при помощи программы GraphPad Prism 8.4.3 (GraphPad Software, Inc., США). Нормальность распределения переменных оценивалась с использованием теста Шапиро-Уилка. Гомогенность дисперсий оценивалась с помощью теста Бартлетта. Данные представлены в виде среднего со стандартным отклонением (М±SD) и медианы с межквартильным размахом (Me (1-3 квартили)).
Для сравнения прозрачности лентикул в рамках одного протокола обработки был использован критерий Уилкоксона и T-критерий Стьюдента для парных и зависимых выборок. Сравнивались связанные выборки в двух разных точках, например контроль-протокол. Сравнение независимых выборок проводилось с помощью критерия Краскела-Уоллиса с последующим post-hoc тестом Данна или t-критерием Уэлча для ненормально и нормально распределенных выборок (с гетерогенными дисперсиями) соответственно. Во всех случаях была использована поправка Холма на множественные сравнения. При оценке результатов статистически значимыми считали результаты при значениях р <0,05.
Результаты исследования и их обсуждение. Как видно из рисунка 1, в группах обработки Трипсином значительно снижена прозрачность по сравнению с контролем, а наиболее приближен к контролю был протокол с использованием NaCl. Проведенный анализ выявил статистически значимые различия в группах NaCl-Контроль (87,67±1,87 против 94,11±1,23; (87,76 (86,96-88,95)) против (94,37 (93,39-95,03)); p<0,0001); Трипсин-ЭДТА -Контроль (62,66±7,53 против 86,55±5,74; (64,88741 (55,87-66,61)) против (85,99 (83,47-91,41)); p<0,0001); также при сравнении NaCl-Трипсин-ЭДТА (87,67±1,87 против 62,66±7,53; (87,76 (86,96-88,95)) против (64,88741 (55,87-66,61)); p<0,0001).
Рис. 1. Среднее спектральное пропускание (%) на длинах волн от 380 до 780 нм:
1 - контрольная группа (n=30), 2 - NaCl (n=15), 3 - Трипсин-ЭДТА (n=15)
Как видно из рисунка 2, содержание ДНК в группах после обработки уменьшилось, что соответствовало стандартному требованию меньше 50 нг ДНК на мг сухого веса. Особенно заметно значительное снижение в группе Трипсин. При попарном сравнении групп t-критерием Уэлча (с поправкой Холма) было выявлено статистически значимое отличие между всеми группами: NaCl-Контроль (39,34±8,65 против 132,18±44,17; (41,99(38,57-44,67)) против (128,5 (102,02-154,48)); p<0,0002); Трипсин-ЭДТА-Контроль (13,42±7,4 против 132,18±44,17; (11,45 (8,47-16,86)) против (128,5 (102,02-154,48)); p<0,0001); NaCl- Трипсин-ЭДТА (39,34±8,65 против 13,42±7,4; (41,99(38,57-44,67)) против (11,45 (8,47-16,86)); p<0,0001).
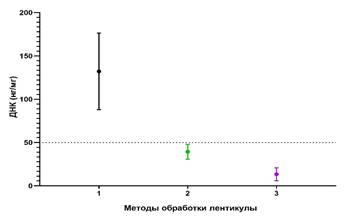
Рис. 2. Измерение количественного содержания ДНК (нг/мг) в зависимости от метода обработки: 1 - контрольная группа (n=10), 2 - NaCl (n=10), 3 - Трипсин-ЭДТА (n=10)
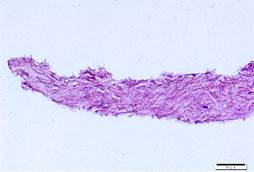
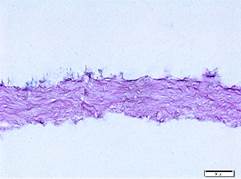
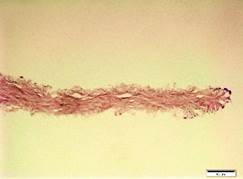
Гистологически при окрашивании гематоксилином и эозином в контрольной группе отмечались сохранность архитектоники стромальной ткани и наличие зрелых кератоцитов, а в группе NaCl было выявлено полное удаление клеток на фоне отсутствия значительного повреждения структуры ВКМ. В группе Трипсин-ЭДТА заметно значительное повреждение ацеллюлярной стромы лентикулы (рис. 3).
|
А |
Б |
В
|
|
|
|
|
Рис. 3. Гистологическая картина лентикулы до и после обработки: А - контрольная группа (n=5), Б - NaCl (n=5), В - Трипсин-ЭДТА (n=5). Окрашивание гематоксилином и эозином, х40
Все протоколы децеллюляризации были эффективны как в отношении удаления клеточного материала, так и оптимально низкого содержания ДНК. Эти данные согласуются с данными Huh M.I. и др., которые в своей работе определили, что 0,25% и 0,5% Трипсин-ЭДТА в сравнении с другими протоколами показали самое низкое содержание ДНК [15]. Кроме того, авторы также проводили оценку прозрачности методом спектрофотометрии, по результатам которых был сделан вывод, что лентикулы после обработки растворами 0,25% и 0,5% Трипсин-ЭДТА показали лучшие результаты среди других. В нашем исследовании группа 0,25% Трипсин-ЭДТА показала значительно низкие результаты прозрачности и при гистологическом окрашивании было отмечено значительное повреждение ацеллюлярного ВКМ. В литературе имеются сведения о разрушительном действии трипсина и нуклеаз на коллагеновую структуру тканей [16]. Основными требованиями, предъявляемыми для создания тканеинженерного конструкта роговицы (ТК), являются такие его свойства, как прозрачность и отсутствие иммуногенности, которые отражаются в сохранении коллагеновой структуры ВКМ и удаления клеточного материала. В нашем исследовании обработка NaCl обеспечила прозрачность, которая была приближена к контролю. При этом анализ содержания ДНК и общегистологическая структура ткани показали удовлетворительные результаты.
Заключение. Таким образом, представленный анализ сравнения эффективных протоколов децеллюляризации для лентикул толщиной 121-148 мкм и диаметром 6,5 мм, полученных при коррекции миопии высокой степени и сложного миопического астигматизма (до -0,75 дптр), констатировал целесообразность разработки и применения протокола NaCl, как наиболее эффективного для создания ТК. Однако следует учесть расхождения в существующей литературе и целесообразность продолжения работы в большем масштабе исследований.