В структуре повреждений таза переломы вертлужной впадины составляют до 25% [1]. Вследствие ускорения темпа жизни, увеличения количества автомобильного транспорта растет и количество переломов вертлужной впадины, так как данный вид повреждений носит преимущественно высокоэнергетический характер. Согласно данным общемировой статистики, частота встречаемости различных типов повреждений вертлужной впадины составляет 3 случая на 100 000 населения в год [2]. Посттравматические дегенеративные изменения внутрисуставного хряща тазобедренного сустава развиваются не только в результате нарушения конгруэнтности суставной поверхности, но и как результат контузионного повреждения суставного хряща. Необходимо учитывать и такой фактор, как длительно существующий болевой синдром, приводящий к нарушению походки и некорректному распределению нагрузки на суставной хрящ, что также способствует возникновению дегенеративных изменений [3]. Основным принципом оперативного лечения данного типа повреждений является раннее оперативное восстановление анатомии вертлужной впадины путем проведения стабильного остеосинтеза. Однако даже после проведения стабильного остеосинтеза результаты лечения часто остаются неудовлетворительными [4].
Дегенеративно-дистрофические изменения тазобедренного сустава, требующие хирургического лечения, развиваются у 12–57% пострадавших [5, 6]. Согласно данным современных исследований, наиболее предпочтительным способом хирургического лечения посттравматического коксартроза является тотальное эндопротезирование тазобедренного сустава, особенно у пациентов старше 55 лет [7-9]. Однако, несмотря на широкое использование данной методики, результаты лечения посттравматического коксартроза хуже, чем при лечении идиопатического коксартроза [10-12]. Последствия травм тазобедренного сустава относятся к одним из самых сложных случаев первичного эндопротезирования по причине наличия дефектов опороспособной костной ткани, значительного нарушения анатомических взаимоотношений в суставе, что часто не оставляет возможности для использования стандартных имплантатов для эндопротезирования [13, 14]. Одним из вариантов решения данной проблемы являются индивидуальные вертлужные имплантаты, изготовленные с помощью аддитивных технологий, количество которых с каждым годом экспоненциально увеличивается [15]. Однако в связи со сравнительно небольшим опытом применения аддитивных технологий по многим вопросам не существует единого мнения, а показания к применению, требования к дизайну и прочностные характеристики индивидуальных имплантатов остаются предметом дискуссий [16].
Целью данного сообщения является демонстрация возможностей использования современных методов предоперационного планирования, проведения тотального эндопротезирования тазобедренного сустава с использованием аддитивных технологий у пациентов с посттравматическим коксартрозом, сопровождающимся значительным разрушением вертлужной впадины.
Клиническое наблюдение. Пациентка П., 62 лет, обратилась в отделение эндопротезирования в 2017 г. Со слов пациентки: в июле 2016 г. она попала в дорожно-транспортное происшествие; бригадой скорой медицинской помощи была доставлена в дежурный травматологический стационар, где был диагностирован перелом лонной, седалищной костей слева. По классификации AO/OTA тип перелома костей таза был оценен как 61 С1.3, перелом вертлужной впадины – как 62 B3.1. Проводилось лечение скелетным вытяжением за бугристость большеберцовой кости в течение 3 недель, после чего пациентка была активизирована и выписана на амбулаторное лечение. В последующем при обращении пациентки в поликлинику диагностированы консолидация переломов лонной, седалищной костей, боковых масс крестца, формирование ложного сустава заднего края, дна вертлужной впадины. Пациентке рекомендовано тотальное эндопротезирование левого тазобедренного сустава. Периферических сосудистых, неврологических, двигательных расстройств нет.
24.10.2018 в плановом порядке госпитализирована в Новосибирский НИИТО с диагнозом: Левосторонний посттравматический коксартроз 3-й стадии, ложный сустав передней колонны, дна, заднего края вертлужной впадины слева с дефектом костной ткани. Нарушение функции сустава 3-й степени. Неопорная левая нижняя конечность. Укорочение левой нижней конечности 2,5 см. Синдром левосторонней коксалгии (рис. 1).
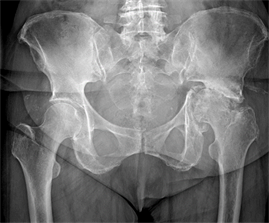
Рис. 1. Рентгенограмма костей таза пациентки П. при поступлении в институт (2018 г.): левосторонний посттравматический коксартоз, перлом дна вертлужной впадины слева
С целью предоперационного планирования пациентке была проведена МСКТ костей таза, на которой было выявлено наличие дефекта вертлужной впадины Pelvic Discontinuity по классификации W.G. Paprosky. Учитывая дефицит опороспособной костной ткани в области вертлужной впадины, неограниченный дефект в переднезаднем направлении, использование стандартного вертлужного компонента для первичного эндопротезирования было бы невозможно. Было принято решение о проведении тотального эндопротезирования с использованием индивидуального вертлужного компонента, для чего был использован метод реконструкции дефектов вертлужной впадины с применением аддитивных технологий.
Процесс изготовления индивидуального имплантата. На основании выполненной МСКТ, используя программное обеспечение, мы получили 3D-модель области дефекта. Готовая модель в формате STL представляет собой множество треугольных граней, которые описывают его поверхность в виде триангулярной сетки. После конвертации данных томографии в формат STL модель не идеальна – она имеет множество пробелов, разрывов и деформаций. Поэтому на данном этапе провели исправление сетки, ребер и полигонов, закрыли отверстия, развернули плоскости в одну сторону, соединили ребра. После получения 3D-модели было определено правильное позиционирование модели с использованием виртуальных линеек.
Вторым этапом провели анализ состояния костной ткани по шкале Хаунсфилда (шкала поглощения рентгеновского излучения). На рисунке 2 видно, что объем дефекта растет с увеличением плотности костной ткани, что свидетельствует о том, что опороспособной костной ткани на самом деле меньше, чем определяется на рентгенограмме, и окончательно ее количество оценивается хирургом визуально во время оперативного вмешательства.
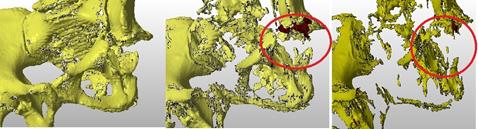
Рис. 2. Пациентка П. Вид 3D-реконструкции костей таза в различных плотностных режимах, плотность костной ткани измеряется в единицах Хаунсфилда, с увеличением плотности костной ткани объем дефекта закономерно увеличивается (более 250 HU, более 400 HU и более 478 HU)
С учетом полученных результатов моделирования и анализа плотности костной ткани в плотностном режиме от 478 до 2132 единиц HU определили форму, объем и геометрию дефекта. Вертлужная впадина сформирована из лонной, подвздошной и седалищной костей, которые закладываются обособленно при рождении и с возрастом сливаются. Если эти кости виртуально разъединить по линии срастания, можно оценить объем и площадь каждой по отдельности и сумму их площадей. Конвертируя значение объема (см3) в процентное соотношение, по значению двух менее поврежденных элементов (крестец и левая половина таза) произвели расчет дефицита площади вертлужной впадины, объема дефектов всех частей вертлужной впадины. Объем дефекта лонной кости составил 2,9 см3, седалищной кости – 5,75 см3, надацетабулярного массива подвздошной кости – 5,2 см3, отсутствовала опороспособная костная ткань в области дна, переднего края и заднего края вертлужной впадины. Для того чтобы восстановить центр ротации левого тазобедренного сустава, было решено изготовить имплантат со сложной геометрией в виде овала с двумя диаметрами: максимальный 72 мм, минимальный 54 мм. Внутренний диаметр имплантата составил 54 мм для создания возможности имплантации стандартного вертлужного компонента цементной фиксации. Для обеспечения дополнительной фиксации в имплантате было сделано 13 технологических отверстий для проведения винтов, причем направление каждого винта было заложено таким образом, чтобы при проведении винт не попадал под срезывающие силы при осевой нагрузке и был бы фиксирован в максимально опороспособной костной ткани (рис. 3).
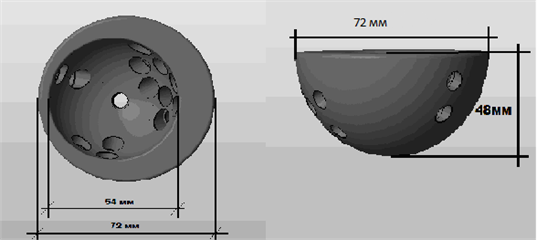
Рис. 3. Эскиз внешнего вида модели индивидуального имплантата области левой вертлужной впадины для пациентки П.
Проведена адаптация полученной виртуальной модели с зоной контакта «имплантат – кость» в месте костного дефекта для достижения максимальной конгруэнтности компонентов имплантата к поверхностям костного дефекта (рис. 4).
После завершения компьютерного 3D-моделирования имплантат был напечатан на 3D-принтере методом SLS-печати (селективное лазерное спекание) из титана LPN-TI64-GD23-TYPE5 по ASTM F136.
После предварительной предоперационной подготовки пациентке было проведено оперативное вмешательство в объеме эндопротезирования левого тазобедренного сустава – имплантации индивидуального вертлужного компонента, в который был фиксирован с помощью костного цемента полиэтиленовый вертлужный компонент 54 мм. После удаления рубцовых тканей и обработки области дефекта была проведена импакционная костная аутопластика аутотрансплантатом из головки бедренной кости. Индивидуальный компонент был имплантирован согласно плану, получена стабильная press-fit фиксация. Для дополнительной фиксации были проведены 2 винта с фиксацией их в лонной и седалищной кости (рис. 5).
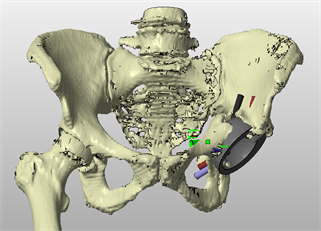
Рис. 4. Вид 3D модели костей таза с индивидуальным имплантатом и планируемым креплением винтами после завершения моделирования (пациентка П.)
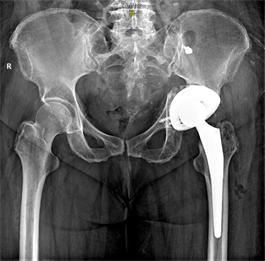
Рис. 5. Рентгенограмма костей таза в прямой проекции на 3-и сутки после операции: компоненты эндопротеза расположены правильно, индивидуальный имплантат левой вертлужной впадины полностью погружен и дополнительно фиксирован двумя винтами (пациентка П.)
Время операции составило 95 минут, кровопотеря – 300 мл. После операции пациентка провела 12 часов в отделении реанимации. На 1-е сутки была активизирована и начала ходить с опорой на костыли с дозированной нагрузкой на левую нижнюю конечность. Стационарный этап лечения составил 15 койко-дней. По рентгенограммам и МСКТ костей таза на 3-и сутки после операции сравнили пространственное положение центра ротации, инклинацию, антеверсию вертлужного компонента, офсет, длину конечностей с планируемым до операции положением (табл. 1).
Таблица 1
Сравнение планируемого и послеоперационного пространственного положения вертлужного компонента
|
Положение компонента |
Офсет (мм) |
Разница длины конечностей |
Антеверсия |
Инклинация |
Вертикальное смещение центра ротации |
Горизонтальное смещение центра ротации |
|
Послеоперационное |
6 |
2 |
13 |
36 |
5 |
–7 |
|
Планируемое |
5 |
0 |
10 |
40 |
2 |
–5 |
На контрольном осмотре через 18 месяцев – объем движений в суставе – ходит с опорой на трость (необходимость во внешней опоре связана с левосторонним гонартрозом 3-й ст. и выраженном синдромом гоналгии). Отмечается улучшение функциональных результатов (табл. 2).
Таблица 2
Функциональные результаты лечения
|
Показатель |
шкала ВАШ |
Harris Hip Score |
SF36 |
Шкала WOMAC |
|
|
PH |
MH |
||||
|
До операции |
7 |
48 |
38 |
55 |
48 |
|
15-е сутки |
2 |
69 |
65 |
59 |
15 |
|
6 месяцев |
1 |
74 |
80 |
75 |
9 |
|
18 месяцев |
0 |
88 |
85 |
80 |
8 |
Обсуждение. При проведении анализа существующих публикаций можно сделать заключение, что в настоящий момент отсутствует общепринятая классификация посттравматических дефектов. Большинство авторов используют классификацию W.G. Paprosky, так как она не только является самой распространенной, но и дает возможность пространственной, а не двухмерной оценки дефекта, позволяет определить тактику оперативного лечения согласно алгоритму, предложенному авторами [17]. При дефектах IIIa, IIIb и Pelvic Discontinuity большинство авторов используют вертлужные компоненты бесцементной фиксации для достижения первичной биологической фиксации, дефекты костной ткани предлагается замещать с помощью различных способов остеопластики, использования опорных аугментов, комбинации этих методов [14].
С развитием современных аддитивных технологий все большее распространение получают методы использования индивидуальных имплантатов, однако с развитием этого направления возникает множество вопросов, касающихся показаний к применению, дизайна, материалов имплантатов, а также способов их фиксации.
Разработка дизайна имплантата и его печать, по данным зарубежной литературы, занимают от 3 недель до 3 месяцев, в конкретном клиническом случае полный цикл от визуализации и моделирования дефекта до оперативного вмешательства составил 19 дней.
В представленном клиническом случае мы пытались показать возможности аддитивных технологий при проведении тотального эндопротезирования тазобедренного сустава в случае наличия разобщенного дефекта вертлужной впадины. В данном случае при проведении эндопротезирования необходимо было обеспечить расклинивание вертлужного компонента с опорой на три зоны – лонную кость, седалищную кость и надацетабулярный массив. При использовании стандартного полусферического компонента возникла бы необходимость в избыточной выработке костной ткани при формировании костного ложа эндопротеза, смещении центра ротации, а направление винтов не позволило бы провести их в плотную опороспособную кость. Таким образом, при планировании дизайна индивидуального компонента перед нами стояли следующие задачи:
1) достижение стабильной первичной биологической фиксации;
2) замещение костного дефекта вертлужной впадины;
3) восстановление биомеханики сустава, близкой к противоположному тазобедренному суставу.
Для решения поставленных задач имплантат был сформирован с учетом геометрии дефекта (внешний размер овальной формы), для замещения дефекта костной ткани надацетабулярного массива и обеспечения максимальной площади контакта в зоне имплантата использовалась сохранная опороспособная кость. Для профилактики смещения центра ротации и восстановления офсета внутренний размер был сделан сферическим и пригодным для имплантации стандартного вертлужного компонента цементной фиксации. Направления отверстий для винтов были спроектированы таким образом, чтобы при имплантации была бы возможность провести винты во все участки костей таза, где, по предварительным исследованиям плотности костной ткани, была бы достигнута прочная фиксация в направлениях, не попадающих под срезывающие силы при нагрузке. Имплантатами выбора у пациентов с посттравматическим дефектом вертлужной впадины являются антипротрузионные кольца, однако данный тип конструкций не обеспечивает биологической фиксации на границе имплантат – нативная кость. По данным литературы, среднесрочные результаты выживаемости антипротрузионных колец, несмотря на тот факт, что в большинстве изученных публикаций авторы использовали индивидуальные трехфланцевые вертлужные имплантаты (CTAC – Сustom Triflange acetabular component) [16], нами не проектировался имплантат с наличием фланцев, так как в этом случае возникли бы следующие сложности:
– направление проведения винтов в подвздошную кость было бы перпендикулярно срезывающим силам, что привело бы к избыточной нагрузке на винты и их деструкции и расшатыванию;
– использование фланцевых конструкций предполагает обширный хирургический доступ и сепарацию мягких тканей и надкостницы, что увеличивает травматичность вмешательства и риск септических осложнений;
– для адаптации седалищного, подвздошного фланцев потребовалась бы дополнительная адаптирующая резекция костной ткани;
– фланцевые конструкции предполагают плотную посадку на кость, и при ошибке в их дизайне и изготовлении будет отсутствовать конгруэнтность, что значительно затрудняет их имплантацию и может стать причиной недостаточной стабильности фиксации.
По данным исследований А.И. Гудза и соавторов, оптимальной конструкцией для имплантации у пациентов с посттравматическим дефектом вертлужной впадины, сопровождающимся диссоциацией тазового кольца, является антипротрузионное кольцо (АПК) Бурха–Шнайдера. В приведенном клиническом случае мы не использовали АПК Бурха–Шнайдера по причине того, что данный имплантат не обеспечивает биологической фиксации.
Заключение. Полученные нами клинические результаты лечения коррелируют с результатами, полученными другими авторами. Среди наиболее часто встречаемых осложнений, указанных в зарубежной и отечественной литературе, превалирует гетеротопическая оссификация, составляющая до 43% [3]; частота вывихов головки эндопротеза составляет от 4,5% до 11,8%, септические осложнения – от 5,7% до 7% [3, 5, 6]. В представленном клиническом случае вышеуказанных осложнений выявлено не было. Большинство авторов указывают в качестве функциональных результатов исследование функции тазобедренного сустава по шкале Harris – результаты после операции составляют от 77 до 88 баллов [5, 6, 17].
Таким образом, представленный клинический случай демонстрирует эффективность использования современных методов предоперационного планирования, проведения тотального эндопротезирования тазобедренного сустава с использованием аддитивных технологий у пациента с посттравматическим коксартрозом, сопровождающимся значительным разрушением вертлужной впадины.
Пациент дал информированное согласие на публикацию клинического наблюдения в открытой печати.



