В последние годы в Российской Федерации показатели эффективности противотуберкулезного лечения остаются недостаточно высокими: эффективность курса противотуберкулезной терапии у впервые выявленных больных туберкулезом пациентов без наличия множественной лекарственной устойчивости (МЛУ) микобактерий туберкулеза (МБТ) отмечалось в 2009 г. – 72,4%; в 2016 г. – 74,3%; в 2017 г. – 71,9% среди всех пролеченных по первому, второму и третьему режимам химиотерапии [1]. При этом рекомендуемая эффективность лечения должна составлять не менее 85% [2]. К объективным причинам снижения эффективности лечения можно отнести возникновение нежелательных побочных реакций (НПР) по гепатотоксическому типу при применении противотуберкулезных препаратов (ПТП) [3].
Во время проведения лечения у впервые выявленных больных туберкулезом без МЛУ используются ПТП основного ряда, такие как изониазид и рифампицин, при применении которых по-прежнему можно достигнуть наилучшего эффекта в лечении пациентов при отсутствии МЛУ у возбудителя туберкулеза. Изониазид может вызывать такие неблагоприятные побочные реакции, как диспепсические расстройства, аллергические, нейротоксические и гепатотоксические реакции [4]. Поражение печени является наиболее распространенной из неблагоприятных побочных реакций на изониазид, так как именно в ней происходят процессы биотрансформации и обезвреживания большинства лекарственных препаратов [5]. Иногда НПР по гепатотоксическому типу при их тяжелом течении могут стать причиной смерти пациентов [6]. При развитии НПР по гепатотоксическому типу противотуберкулезная терапия приостанавливается до устранения НПР, в качестве средств патогенетической терапии назначаются эссенциальные фосфолипиды, орнитин, препараты янтарной кислоты, урсодезоксихолиевой кислоты и др. [7]. В дальнейшем возобновление приема изониазида и рифампицина возможно только под «прикрытием» гепатопротекторами и под контролем уровня аминотрансфераз. Таким образом, во время, которое требуется на ликвидацию НПР по гепатотоксическому типу, противотуберкулезные препараты пациентом не принимаются, а это способствует увеличению риска развития МЛУ МБТ.
Риск развития гепатотоксических побочных реакций на изониазид связан не только с генетическими, но и с приобретенными факторами, к которым можно отнести сопутствующую патологию печени, злоупотребление алкоголем, прием наркотиков и др. Тем не менее несомненна роль генетических факторов, которые изначально определяют активность процессов, участвующих в полноценной биотрансформации изониазида [6].
N-ацетилтрансфераза 2-го типа (NAT2) остается главным ферментом, ответственным за метаболизм и инактивацию изониазида в организме человека. Этот фермент катализирует перенос ацетильной группы от кофактора ацетил-коэнзима А (ацетил-КоА) к концевому азоту препарата. NAT2 кодируется геном NAT2, и в многочисленных генетических исследованиях было показано, что различные варианты гена NAT2 были непосредственно связаны с появлением различных фенотипов ацетилирования [6].
Гены NAT2 являются полиморфными, и олигонуклеотидный полиморфизм (SNPs) может привести к изменению активности этого фермента, что является генетической основой для объяснения таких фенотипических особенностей, как наличие так называемых быстрых, промежуточных и медленных ацетиляторов [6].
Наличие полиморфизмов в гене NAT2 может быть определено с помощью процедур генотипирования, таких как ПЦР, аллельспецифическая ПЦР, или прямого секвенирования. Многочисленные исследования показали, что частота встречаемости различных типов ацетилирования в этнически различных популяциях неодинакова. В азиатской и южноамериканской популяциях фенотип «быстрых» ацетиляторов встречается чаще, тогда как в европейской на долю «медленных» ацетиляторов приходится до 50% исследуемой популяции [6].
В течение длительного времени применение изониазида объясняло наибольшее количество НПР по гепатотоксическому типу при лечении пациентов противотуберкулезными препаратами. Во многих исследованиях была выявлена связь между приемом изониазида на фоне определенного фенотипа ацетилирования и частотой развития НПР по гепатотоксическому типу. В некоторых исследованиях медленный фенотип ацетилирования рассматривался как причина повышенного риска НПР по гепатотоксическому типу. В других исследованиях наблюдалось отсутствие связи между фенотипом ацетилирования и НПР по гепатотоксическому типу при лечении больных туберкулезом, а в некоторых работах полученные результаты свидетельствуют о том, что именно при наличии фенотипов, определяющих быстрые механизмы ацетиляции, наиболее часто развиваются такие НПР. Разница в полученных результатах этих исследований, наиболее вероятно, объясняется использованием различных методах генотипирования в различных популяциях. Например, ферментативный метод, использованный в некоторых исследованиях, может быть недостаточно точным. Также некоторые исследователи используют небольшое количество SNPs для определения предполагаемого типа ацетилирования у пациентов. Так как в различных популяциях были выявлены неодинаковые SNPs гена NAT2, а в некоторых исследованиях также выявились новые мутации, влияющие на активность ферментов NAT2, целесообразно проводить поиск связей между генотипом и фенотипом ацетилирования в конкретной исследуемой популяции. В ином случае можно получить неверные результаты о соотношении быстрых и медленных ацетиляторов, а также ошибочные корреляции при их интерпретации. Тем не менее в большинстве исследований получена информация о том, что частота развития НПР по гепатотоксическому типу, которые могут возникнуть при применении изониазида, была значительно выше при наличии медленного фенотипа ацетилирования, в отличие от быстрого или промежуточного фенотипов. Таким образом, показано, что наличие определенного фенотипа ацетилирования может являться фактором риска развития НПР по гепатотоксическому типу при приеме противотуберкулезных препаратов, в частности изониазида. Также имеются результаты метаанализа данных 14 исследований за период 2000–2011 гг., в котором предпринята попытка решить проблему недостаточной статистической мощности на основе накопленных данных из небольших по объему выборок в различных популяциях (в основном азиатских). В результате было показано, что наличие у больных туберкулезом медленного генотипа ацетилирования способствует более высокому риску развития НПР по гепатотоксическому типу, чем у пациентов, имеющих быстрый или промежуточный генотип ацетилирования [8].
Следует отметить, что указанные выше исследования выполнялись в популяциях Африки, Южной Америки и Азии. Таких масштабных исследований на европейской популяции, в том числе и на территории России, практически не проводилось.
В исследовании, проведенном нами ранее, установлено, что на развитие НПР по гепатотоксическому типу при применении противотуберкулезных препаратов первого ряда у впервые выявленных больных туберкулезом влияет наличие таких мутаций в гене NAT2, как SNPs АА rs1799931, SNPs AA или AG rs1799930, а также SNPs TT или CT rs1041983, которые определяют активность фермента NAT2 [9]. Однако исследования генетического полиморфизма гена NAT2 в указанных SNPs для профилактики НПР по гепатотоксическому типу у больных туберкулезом ранее не проводились.
Цель исследования: оценить частоту развития нежелательных побочных реакций по гепатотоксическому типу при проведении гепатопротективной терапии по результатам генетического исследования SNPs rs1799931, rs1799930 и rs1041983 гена NAT2.
Материалы и методы исследования
В исследовании приняли участие 147 пациентов в возрасте от 5 до 60 лет. В основную группу вошел 71 пациент (у которых проводили профилактику гепатотоксических реакций с учетом генетического исследования), а 76 пациентов (у которых профилактика гепатотоксических реакций проводилась без учета генетического обследования) составили контрольную группу.
Пациенты обеих групп получали противотуберкулезные препараты изониазид в дозе 10 мг/кг/сут и рифампицин в дозе 10 мг/кг/сут. Наличие или отсутствие нежелательных побочных реакций по гепатотоксическому типу оценивали по клиническим признакам (наличие жалоб, объективное обследование) и результатам общего и биохимического анализа крови.
НПР по гепатотоксическому типу на противотуберкулезные препараты отмечались при повышении билирубина, АлАТ и АсАТ более чем в 3 раза относительно нормы и (или) при наличии тошноты и (или) рвоты во время лечения.
В качестве предикторов гепатотоксичности при приеме комплекса противотуберкулезных препаратов первого ряда у больных туберкулезом по результатам проведенных ранее исследований мы рассматривали наличие SNPs АА rs1799931 гена NAT2 и SNPs AA и AG rs1799930 гена NAT2, а также присутствие мутаций TT или CT SNPs rs1041983 гена NAT2 [9].
Пациентам, вошедшим в основную группу, имеющим указанные типы мутаций в генах NAT2, в качестве профилактики развития гепатотоксических реакций назначались гепатопротекторы (урсодезоксихолиевая кислота) в дозе 10 мг/кг/сут (максимальная суточная доза – 750 мг). В контрольной группе гепатопротекторы назначались всем пациентам в аналогичных дозировках.
Проведение общего и биохимического анализа крови проводилось на автоматических гематологическом и клиническом анализаторах («Sysmex kx-21», «Sapphire 400») с применением реагентов «Human». Для проведения генетического исследования цельная кровь из вены забиралась в пробирку с этилендиаминтетрауксусной кислотой. Данные образцы подвергались заморозке и хранились при температуре –30°С. Выделение геномной ДНК из этих образцов проводилось с помощью наборов реагентов Arrow Blood DNA 500 на станции NorDiag Arrow. Постановка полимеразной цепной реакции (ПЦР) осуществлялась согласно протоколу производителя реагентов в режиме реального времени на амплификаторе CFX-96 с применением наборов реагентов для генотипирования SNPs TaqMan по 3 точкам: C_572770_20, С_1204091_10, C_8684085_20. Для получения достоверных результатов с четкой кластеризацией во всех исследуемых образцах концентрация ДНК составляла 5 ng на реакцию.
В основной группе в качестве возможных предикторов НПР по гепатотоксическому типу определялось наличие SNPs гена NAT2: rs1799931, rs1799930, rs1041983.
Статистическая обработка полученных данных выполнялась при помощи программы IBM SPSS версии 23.0. Описательная статистика результатов исследования представлена для качественных величин в виде процентных долей и их стандартных ошибок, для абсолютных – в виде средних арифметических (М) и стандартных отклонений (σ). Значимость различий качественных признаков оценивали при помощи критерия χ2 Пирсона, различия между количественными признаками определяли при помощи U-критерия Манна–Уитни. Статистически значимыми считались различия от р<0,05.
Результаты исследования и их обсуждение
В контрольной группе пациентов, получающих лечение противотуберкулезными препаратами и профилактику гепатотоксических реакций без учета оценки генетического полиморфизма, НПР по гепатотоксическому типу наблюдались у 23 пациентов из 76 (30,3±5,3%). Больше НПР зафиксировано среди взрослых пациентов – у 17 из 50 (34,0±6,7%). Среди пациентов детского возраста частота развития НПР по гепатотоксическому типу составила 21,4±7,8% (у 6 из 28). Однако статистически значимых различий по частоте возникновения гепатотоксических реакций среди детей и взрослых контрольной группы не отмечено (Хи-квадрат с поправкой Йетса 0,827, p>0,05). Из 40 женщин контрольной группы НПР по гепатотоксическому типу были зафиксированы у 15 (37,5±7,8%), а из 36 мужчин – только у 8 (22,2±6,9%), однако эти различия оказались статистически не значимы (Хи-квадрат с поправкой Йетса 1,434, p>0,05).
В основной группе пациентов, получающих лечение противотуберкулезными препаратами и профилактику НПР по гепатотоксическому типу с учетом оценки генетического полиморфизма, указанные НПР наблюдались у 7 из 71 (9,9±3,5%) (рисунок).
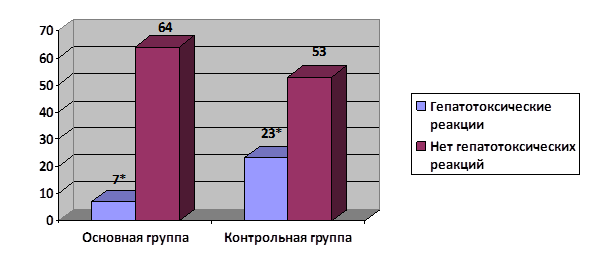
Частота развития НПР по гепатотоксическому типу. *– p<0,05
Таким образом, в основной группе пациентов статистически значимо встречались гепатотоксические нежелательные побочные реакции (Хи-квадрат с поправкой Йейтса 8,194, p<0,05).
Нежелательные побочные реакции по гепатотоксическому типу у 15 пациентов из 30 (50±9,1%) проявлялись в виде таких изменений лабораторных показателей, как повышение АлАТ и АсАТ в биохимическом анализе крови более чем в 3 раза относительно нормы. НПР по гепатотоксическому типу у 11 пациентов (36,7±8,8%) проявлялись в виде диспепсических явлений, болезненности при пальпации в области живота и изменений лабораторных показателей. У 8 пациентов (34,8%) контрольной группы НПР по гепатотоксическому типу потребовали отмены противотуберкулезных препаратов, изменения схемы лечения и назначения дезинтоксикационной и гепатопротективной терапии. В основной группе у 2 пациентов (28,6±8%) гепатотоксические реакции потребовали отмены противотуберкулезных препаратов и внесения изменений в схему лечения. Среднее значение АлАТ и АсАТ в основной группе у пациентов с проявлениями НПР по гепатотоксическому типу составило 303,4±241,1 ед/л и 118,7±49,7 ед/л соответственно. В контрольной группе эти показатели составили 180,7±113,8 ед/л и 179,2±126,1 ед/л соответственно. В основной группе средний показатель активности АлАТ в биохимическом анализе крови составил 35,8±20,1 ед/л, в контрольной группе – 71,8±68,8 ед/л (различия в уровнях выборок можно считать несущественными, U=2239), а АсАт – 35,8±20,1 ед/л и 74,8±65,6 (различия в уровнях выборок можно считать несущественными, U=1817,5). Следует отметить, что одни лишь результаты биохимического анализа крови не всегда являлись определяющими в констатации НПР по гепатотоксическому типу и часто также сопровождались клиническими проявлениями, даже если значение показателей АлАТ и АсАТ не превышало 3 значений норм.
Исходя из полученных результатов представляется оптимальным проведение профилактики гепатотоксических реакций у впервые выявленных больных туберкулезом при проведении противотуберкулезной терапии по I и III режиму с учетом данных, полученных при определении мутаций гена NAT2 (SNPs rs1799931, rs1799930 и rs1041983). Данный подход позволяет статистически значимо сократить частоту развития побочных реакций в сравнении с подходом, предполагающим назначение препаратов группы гепатопротекторов всем пациентам.
Выводы
1. Лечение впервые выявленных больных туберкулезом с применением ПТП первого ряда (изониазид, рифампицин, пиразинамид) без использования оценки генетического полиморфизма сопровождалось возникновением нежелательных побочных реакций по гепатотоксическому типу в 30,3% случаев, а с учетом оценки генетического полиморфизма – в 10,9%.
2. Использование для оценки риска развития НПР по гепатотоксическому типу определения мутаций гена NAT2 (SNPs rs1799931, rs1799930 и rs1041983) у впервые выявленных больных туберкулезом статистически значимо снижает частоту развития данного вида нежелательных побочных реакций в сравнении с подходом, предполагающим назначение препаратов группы гепатопротекторов всем пациентам.



