Рак молочной железы (РМЖ) занимает особое место в структуре заболеваемости и смертности женского населения. В Российской Федерации за последние годы зарегистрировано около 1,38 млн новых случаев рака данной локализации [1]. При этом профессиональным сообществом признается факт сложного контроля за ростом заболеваемости РМЖ по причине отсутствия эффективных путей первичной профилактики. До сих пор нерешенными остаются вопросы применения имеющихся прогностических маркеров и предикторов в ежедневной практике онколога, спектр которых неуклонно растет.
В настоящее время сформировано представление о том, что РМЖ – группа гетерогенных опухолей с различными биологическими свойствами, на основании чего проводится их выделение в соответствующие подтипы, имеющие выраженные отличия по экспрессии отдельных маркеров, характеру протекания заболевания, ответу на проводимое лечение и прогнозу развития заболевания. Более того, внутри соответствующего подтипа выделяются отдельные больные, значительно отличающиеся по срокам развития рецидива заболевания и его прогрессирования [2].
За последние десятилетия показано, что у 30–90% пациентов с первичным РМЖ могут развиться отдаленные метастазы [3]. Вероятно, распространение опухолевых клеток происходит на ранних стадиях, однако они долгое время могут находиться в дормантном состоянии, что, по мнению ряда авторов, может быть объяснено с позиций «теории опухолевых стволовых клеток (ОСК)» [4].
Опухолевые стволовые клетки (ОСК, cancer stem cells) – особая часть гетерогенной опухолевой популяции, участвующая в формировании и росте первичного и метастатического очага, обусловливающая высокую резистентность к различным видам терапии за счет наличия клеточных систем детоксикации (например, ABC-транспортеров) [5].
Действие разнообразных факторов микроокружения ОСК приводит к значительному изменению профиля поверхностных маркеров, биологических характеристик ОСК, что обусловливает разнообразие этих клеток. Вероятно, гетерогенность, присущая опухоли в принципе, проявляется уже на уровне ее стволовых клеток. Кроме того, не во всех случаях отмечено соответствие между «стволовым» фенотипом опухолевых клеток и их способностью вызывать опухолевый рост на моделях in vivo [6].
Для идентификации ОСК РМЖ наиболее часто используют такие маркеры, как ESA+, СD44+ и СD24+[7], а также ALDH1+, Oct-4+ [8].
Появляется все больше свидетельств того, что агрессивная природа опухолей молочной железы может быть обусловлена наличием более высокой частоты присутствия ОСК с фенотипом CD44hiCD24low/- [9, 10, 11, 12]. Напротив, люминальные РМЖ, как полагают, являются преимущественно ALDH+ (CD44+CD24low/-ALDH1+) [13]. Эти наблюдения позволяют предположить, что подгруппа ОСК в опухолях является гетерогенной по природе в отношении фенотипа и, возможно, по-разному функционирует среди различных подтипов РМЖ.
Цель работы – изучить фенотипические характеристики опухолевых клеток с фенотипом стволовых в ткани регионарных и дистантных метастазов при опухолях молочной железы.
Материалы и методы исследования
Проведено ретроспективное исследование, в которое были включены 20 больных РМЖ с регионарными (в лимфатические узлы) и дистантными метастазами (в легкие, печень, головной мозг) в возрасте от 42 до 74 лет (средний возраст 56,1±3,3 года).
В опухоли и ткани метастазов производили несколько параллельных горизонтальных разрезов через всю опухоль, избегая очагов некроза. Для фиксации материала использовали раствор 10%-ного нейтрального формалина с последующей стандартной проводкой и получением парафиновых блоков. На микротоме готовили срезы толщиной 3–5 мкм с последующим их окрашиванием гематоксилином и эозином.
Парафиновые срезы депарафинировали и регидратировали по стандартной методике. «Демаскировку» антигенов проводили в PT-LinkThermo. Протокол включал в себя предварительный нагрев до 65°C, восстановление антигена в течение 20 минут при температуре 97°C и дальнейшее охлаждение до 65°C. Затем стекла промывали в течение 1–3 минут TBS-буфером (CellMarque), помещали для окрашивания в автостейнер Thermo Scientific.
Для определения экспрессии CD44 и CD133 на опухолевых клетках иммуногистохимическим методом использовали моноклональные мышиные антитела к CD44 клон 156-3С11 (Thermo Scientific) в разведении 1:2500 и поликлональные кроличьи антитела к CD133 (Cloud-Clone Corp.) в разведении 1:700 с использованием автостейнера Thermo Scientific 480; для демаскировки антигена CD133 применяли буфер 10 мМ Tris, 1 мМ EDTA (рН 8,0), для CD44 – цитратный буфер (Abcam) (рН 6,0).
Оценивали мембранную окраску, характеризовали интенсивность окрашивания клеточной мембраны: 0, 1+ слабое, 2+ умеренное, 3+ сильное окрашивание. При наличии интенсивности окрашивания 2+ и 3+ случай рассматривался как позитивный. Экспрессия белка CD44 определялась как положительная при окрашивании в 10% (cut-off) и более всех опухолевых клеток, а в случае с CD133 – в более 5%.
На основании полученных результатов осуществляли расчет средних значений, стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между показателями экспрессии маркера в первичной опухоли и в ткани региональных и дистантных метастазов по критерию χ2 Пирсона. Различия считали статистически значимыми при р≤0,05.
Результаты исследования и их обсуждение
Пациентки с РМЖ, отобранные для данного исследования, характеризовались наличием как регионарных (в лимфатические узлы), так и дистантных метастазов. Последние были представлены вторичными опухолями, локализованными в легких, головном мозге и печени. В соответствии с задачами проводимого исследования осуществлялась идентификация ОСК с выбранными маркерами в указанных региональных и дистантных метастазах.
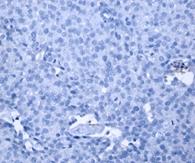
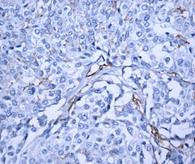
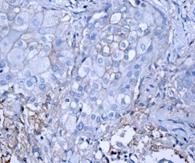
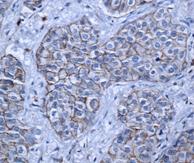
Для обнаружения ОСК при раке молочной железы (ОСК-РМЖ) используются аналогичные фенотипические маркеры, как и при ряде других солидных опухолей. В нашей работе мы применяли иммуногистохимический подход к идентификации данных клеток. На рисунках 1–4 представлены примеры полученных результатов ИГХ окрашивания препаратов опухоли, региональных и дистантных метастазов при РМЖ для выявления CD44+ и CD133+-клеток. Полученные результаты определения числа экспрессирующих выбранных маркеров ОСК-РМЖ представлены в таблице.
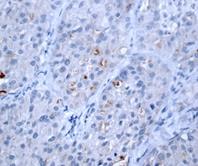
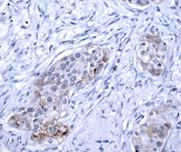
Из полученных результатов видно, что в ткани опухоли молочной железы (РМЖ) экспрессия CD44+ обнаружена в 80% случаев (16 образцов), при этом в 20% случаев данный маркер не определялся. Средний уровень экспрессии CD44 составил 27,2±13,9% (таблица, рис. 1).
Выявлено, что частота экспрессии CD44 в регионарных метастазах РМЖ (в лимфатических узлах) составила 35% с колебанием данного показателя от 0% до 30%, в среднем составив 17,0±6,8% (таблица, рис. 2), что указывает на значимое отличие данного показателя от уровня в первичном очаге (χ2=8,286 при р<0,004).
В различных дистантных метастазах РМЖ уровень экспрессии CD44 был различен (таблица, рис. 3). Так, экспрессия CD44+ была выявлена в 60% случаев при метастазах в легкие (от 20% до 75%), в среднем составив 41,4±13,4%, при метастазах в головной мозг – в 30% случаев (от 0% до 60%), в среднем составив 23,3±17,8%, а при метастазах в печень данный показатель был отрицателен. Найденные отличия также были статистически значимы (χ2=30,077 при р<0,001).

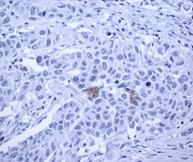

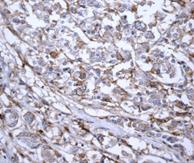

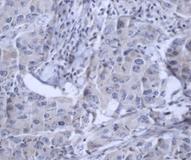

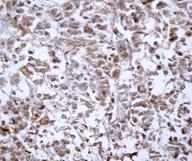
Рис. 1. Экспрессия маркеров ОСК в опухоли при РМЖ: А – отрицательная экспрессия CD44; В – положительная экспрессия CD44 (2+); C – отрицательная экспрессия CD133 (1+). D – положительная экспрессия CD133 (3+). Ув. х400

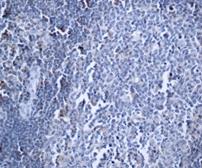

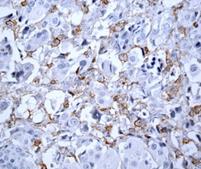

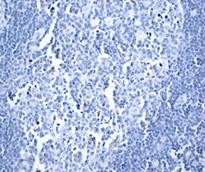

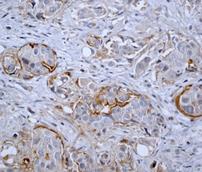
Рис. 2. Экспрессия маркеров ОСК в регионарных метастазах (ЛУ) опухоли при РМЖ: А – отрицательная экспрессия CD44; В – положительная экспрессия CD44 (3+); С – отрицательная экспрессия CD133; D – положительная экспрессия CD133 (3+). Ув. х400
|
|
|
|
|
|
Рис. 3. Экспрессия CD44 маркера в дистантных метастазах опухоли РМЖ:
А – отрицательная экспрессия CD44, метастаз в головной мозг. В – отрицательная экспрессия CD44 (1+), метастаз в головной мозг. С – отрицательная экспрессия CD44 (1+), метастаз в легкое. D – положительная экспрессия CD44 (2+), метастаз в легкое. Ув. х400
|
|
|
|
|
|
Рис. 4. Экспрессия CD133 маркера в дистантных метастазах опухоли РМЖ:
А – отрицательная экспрессия CD133, метастаз в головной мозг. В – отрицательная экспрессия CD133 (1+), метастаз в легкое. C – положительная экспрессия CD133 (2+), метастаз в легкое. Ув. х400
Экспрессия маркеров ОСК в клетках опухоли рака молочной железы, регионарных и дистантных метастазах
|
CD44 % экспрессирующих маркер клеток (число случаев) |
CD133 % экспрессирующих маркер клеток (число случаев) |
|||
|
CD44+ |
CD44- |
CD133+ |
CD133- |
|
|
ОПУХОЛЬ |
80% (16) |
20% (4) |
80% (16) |
20% (4) |
|
средние значения позитивных клеток, % |
27,2±13,9 |
56,0±14,6 |
||
|
МЕТАСТАЗ, региональный (ЛУ) |
35% (7) |
65% (13) |
15% (3) |
85% (17) |
|
средние значения позитивных клеток, % |
17,0±6,8 |
33,0±15,4 |
||
|
МЕТАСТАЗ, Дистантный Легкое |
60% (12) |
40% (8) |
20% (4) |
80% (16) |
|
средние значения позитивных клеток, % |
41,4±13,4 |
3,6±2,05* р≤0,001 |
||
|
Печень |
– |
100% (20) |
– |
100% (20) |
|
средние значения позитивных клеток, % |
– |
– |
||
|
Головной мозг |
30% (6) |
70% (14) |
– |
100% (20) |
|
средние значения позитивных клеток, % |
23,3±17,8* р≤0,001 |
– |
||
* – статистически достоверные различия уровня экспрессии маркера по сравнению с первичной опухолью РМЖ
CD44 – поверхностный гликопротеид, рецептор для гиалуронана (ГА) – линейного гликозамингликана, основного компонента внеклеточного матрикса, участвующего в межклеточных взаимодействиях и определяющего таким способом подвижность клеточных элементов. Отмечается, что в результате присоединения ГА к CD44 активируются многие рецепторные тирозинкиназы, в том числе EGFR и ERBB2, что обусловливает закономерное изменение структурно-функциональных свойств клетки, изменение ее миграционной активности. В норме данная структура представлена на различных соматических клетках, но уровень ее экспрессии увеличивается при опухолевой трансформации. В результате проведенных ранее исследований показано, что СD44 регулирует инвазивные и пролиферативные свойства опухолевых клеток, включая клетки молочной железы, а также процессы ангиогенеза [14]. Представляет особый интерес тот факт, что данная молекула характеризуется наличием нескольких изоформ. Показано, что в результате альтернативного сплайсинга и вариации в посттрансляционных модификациях в виде N- и O-гликозилирования возникают молекулы, отличающиеся структурными и функциональными особенностями, что в свою очередь обусловливает дифференциальную роль изоформ CD44 в патогенезе различных опухолей, в том числе и РМЖ [14].
У больных РМЖ наличие субпопуляции CD44+CD24low в образцах опухоли коррелировало с наличием отдаленных метастазов, особенно в костях [15].
По-видимому, опухолевые клетки с фенотипом стволовых закономерным образом изменяют свой фенотип, испытывая на себе воздействие различных факторов микроокружения, что позволяет данным клеткам наиболее эффективно приспособиться к новым условиям. В нашей работе мы обнаружили, что количество ОСК-РМЖ с фенотипом CD44+ уменьшается в региональных метастазах (ЛУ), в то время как в различных дистантных метастазах либо превышает данный показатель в первичной опухоли (метастаз в легкое), либо находится в его пределах (метастаз в головной мозг). Эти результаты могут указывать на некоторые особенности соответствующих тканей, где наблюдается развитие метастаза.
Другим маркером, который достаточно часто исследуется при определении ОСК солидных опухолей, является CD133, функциональная роль которого в биологии соматических клеток, а также в ОСК-РМЖ изучена в меньшей степени.
CD133 (АС133, проминин-1) впервые был обнаружен на гемопоэтических стволовых клетках в 1997 г. [16]. Это трансмембранный гликопротеин с молекулярной массой 120 кД, взаимодействующий с холестеролом [17], принадлежит к семейству промининов, определяются 3 его изоформы: CD133-1, CD133-2, CD133-3. Данная молекула аккумулируется в мембранных выпячиваниях, но ее функциональная роль точно не известна.
В результате проведенного исследования наличие CD133+ в ткани опухоли РМЖ выявлялось в 80% случаев при среднем уровне экспрессии данного маркера 56,0±14,6%, с преобладанием положительного цитоплазматического окрашивания в 60% случаев (таблица, рис. 1).
Определение данного маркера в регионарных метастазах (лимфатических узлах) РМЖ позволило получить положительный результат в 15% случаев (3 образца), с колебанием экспрессии от 0% до 60%, при этом средний уровень экспрессии был 33,0±15,4 (таблица, рис. 4), достоверно отличаясь от уровня данного показателя в опухоли (χ2=16,942 при р<0,001).
В дистантных метастазах наличие CD133-маркера при РМЖ наблюдалось в 20% случаев при метастазах в легкие, с колебанием от 0% до 10%, в среднем составив 3,6±2,05% (таблица), что также достоверно отличалось от уровня данного показателя в опухоли (χ2=40,867 при р<0,001). Следует отметить, что в метастазах в печень и головной мозг экспрессия CD133 была отрицательная.
Таким образом, выявлено, что в первичной опухоли РМЖ отмечается наибольшее количество ОСК, экспрессирующих CD133 маркер, а для метастазов показано выраженное снижение клеток данного фенотипа, причем в дистантных метастазах количество этих клеток и уровень экспрессии рассматриваемого маркера наименьшие.
Заключение
Полученные результаты определения экспрессии выбранных маркеров ОСК указывают на некоторые особенности распределения данных клеток в первичной опухоли и в различных метастазах. Вследствие того что в последнее время с ОСК ассоциируют и такой тип опухолевых клеток, как циркулирующие опухолевые клетки, можно предположить, что выявленные закономерности отражают в определенной степени особенности миграции клеток и формирования метастатических поражений.
Для объяснения характера поведения опухолевых клеток с фенотипом стволовых особый интерес представляет концепция «мигрирующих ОСК», предложенная Brabletz et al. еще в 2005 г. [18]. В основе данной концепции лежат представления о том, что потенциально существует две формы ОСК, которые обусловливают опухолевую прогрессию. Эти две формы раковых клеток представлены так называемыми стационарной ОСК и мобильной ОСК.
Стационарные ОСК неподвижны и всегда окружены эпителиальными тканями. Эти клетки ответственны за формирование трансформированных потомков, формирующих первичную опухоль. В настоящий момент остается открытым вопрос о наличии у данных популяций ОСК фенотипических особенностей, но поиск ответа на данный вопрос продолжается, и, вероятно, для его решения необходимо дальнейшее развитие в том числе и методических подходов к изучению обсуждаемых явлений.
В отличие от них, «мобильные ОСК», как правило, расположены на границе опухоли и здоровых тканей организма [18]. Для данных клеток характерным свойством является способность к эпителиально-мезенхимальному переходу (EMT), лежащему в основе сохранения стволоподобных свойств и повышенной мобильности [19]. Оба этих свойства имеют важное значение в осуществлении дальнейшей злокачественной прогрессии. Появление данной субпопуляции «мигрирующих ОСК» ознаменовывает «срыв гомеостаза эпителиальной ткани», что сопровождается потерей данными клетками эпителиального фенотипа с последующим увеличением миграционной активности.
Появление и увеличение числа данных субтипов ОСК, характеризующихся повышенной ядерной экспрессией β-катенинов, а также наличие некоторых дополнительных функциональных молекул и их топографическое расположение ближе к краю опухоли, по мнению ряда исследователей, лежат в основе процесса метастазирования солидных опухолей [18, 20, 21].
Изучение роли ОСК-РМЖ представляется весьма перспективным для решения как фундаментальных, так и прикладных проблем онкологии, особенно для дальнейшей разработки новых стратегий лекарственной терапии больных с данной патологией [22].
Таким образом, полученные результаты позволяют сделать вывод о процентном преобладании CD44+- и CD133+-клеток в первичной опухоли по сравнению с тканью метастазов. Исключением является повышенное содержание CD44+-клеток при метастазе РМЖ в легкое.