Адгезия и пролиферация животных клеток характеризуется весьма высокой чувствительностью к изменению параметров внешних условий, состава среды, агентов для со-культивирования и адгезивных свойств материала поверхности. Механотрансдукцией внешних воздействий обуславливается особая сложность подбора условий культивирования, обеспечивающих возможность поддержки пролиферации клеток in vitro длительное время. Установлено, что ротационное культивирование во вращающемся биореакторе оказывает на клетки опосредованное механическим раздражением воздействие, а также способствует более глубокому проникновению клеток в структуру материала, улучшению снабжения клеток кислородом и питательными веществами, а также удалению продуктов метаболизма [1].
Широкое применение в исследованиях цитосовместимости материалов нашел МТТ-тест, основанный на колориметрической оценке активности клеток по интенсивности реакции восстановления тетразолиевого красителя НАДФ-H-зависимыми оксидоредуктазными ферментами. Среди недостатков этого метода отмечают накопление конечных продуктов в клетке и невозможность дальнейшего использования биоматериала вследствие цитотоксичности продуктов реакции [2]. При этом заселение клеток на высокопористые микроволокнистые материалы приводит к их миграции не только по поверхности, но и вглубь материала - от 100 мкм [3] до 250 мкм и более [4]. Это может сказываться на результатах оценки метаболической активности клеток, при тестировании материалов различной морфологии и толщины, что в свою очередь требует модификации МТТ-теста и подбора подходящего растворителя полимерного каркаса [2].
Проведенное нами ранее исследование метаболической активности линейных клеток NIH/3T3 и MCF-7 позволило выявить различия в значениях оптической плотности для статичного и динамического культивирования на различных микроволокнистых синтетических материалах: поликапролактоне, диацетате целлюлозы, поли(D,L-лактид-со-гликолиде) и поли(L-лактид-со-капролактоне). Так, в отношении материалов из микроволокнистого поликапролактона было отмечено, что увеличение диапазона диаметров волокон от ∅ 0,3–2,7 мкм к ∅ 5–21 мкм связано с лучшей пролиферацией заселенных на них клеток как при статичном, так и при динамическом культивировании, что может быть связано с увеличением эффективной площади поверхности для клеточной адгезии [5].
Предполагалось, что данные различия могут быть обусловлены влиянием физико-химических свойств материала на миграцию и пролиферацию клеток, однако закономерности проявления таких различий для совокупности выбранных полимерных материалов оставались неизвестными.
Цель исследования: оценить влияние толщины каркаса из микроволокнистого синтетического материала на его цитосовместимость при заселении линейными культурами клеток NIH/3T3 и MCF-7 и использовании стандартного МТТ-теста.
Материалы и методы исследования
Микроволокнистые материалы
Исследование адгезивной и метаболической активности выполнялось на микроволокнистых полимерных материалах: поликапролактоне (ПКЛ), диацетате целлюлозы (ДЦ), поли(D,L-лактид-со-гликолиде) (ПЛГА), поли(L-лактид-со-капролактоне) (ПЛК), с морфологическими характеристиками, описанными ранее [5].
Клеточные культуры
Метаболическую активность клеток исследовали с использованием стандартных линий клеток фибробластов мыши NIH/3T3 и аденокарциномы молочной железы человека MCF-7.
Культивирование клеток
Клетки MCF-7 и NIH/3T3 культивировали в СО2-инкубаторе (Thermo Fisher Scientific) в течение 7 суток в стандартных условиях при температуре 37 °C, 5% CO2 и увлажненной атмосфере. Полная питательная среда состояла из DMEM/F12+10%FBS (Gibco) с добавлением 1% пенициллина/стрептомицина (Gibco).
Ротационное культивирование проводилось с помощью программируемого ротатора RM-1 (Elmi) при медленном осевом вращении цилиндрической криопробирки с воздействием на образцы центробежного ускорения ~10-4 g.
МТТ-тест
Метаболическую активность клеток на 7-е сутки культивирования исследовали путем проведения МТТ-теста по стандартному протоколу, как описано ранее [5], добавляли в лунки или криопробирки с заселенными каркасами МТТ-реагент и инкубировали в течение 4 ч при 37 °С, что приводило к образованию нерастворимых в воде фиолетовых кристаллов. Далее среду удаляли, вносили по 200 мкл ДМСО (Sigma) для растворения кристаллов, и полученный окрашенный раствор переносили в 96-луночный планшет по 100 мкл/лунку. Оптическую плотность измеряли на спектрофотометре Multiskan FC (Thermo Fisher Scientific) при длине волны 540 мм. Отрицательным контролем служили лунки без клеток, наполненные полной питательной средой.
Статистическая обработка
Статистическую обработку различий в относительном росте количества заселенных на материалы клеток при динамическом и статическом культивировании проводили в программе GraphPad Prism 7.0, используя двухфакторный дисперсионный анализ (two-way ANOVA). В качестве уровня статистической значимости принимали p<0,05.
Результаты исследования и их обсуждение
Результаты
Проведен анализ исходных данных МТТ-теста, полученных нами ранее при исследовании метаболической активности фибробластоподобных (NIH/3T3) и эпителиальноподобных (MCF-7) линейных клеток при культивировании на микроволокнистых материалах в статичном и динамическом режимах. Выявлено, что метаболическая активность клеток на образцах при динамичном культивировании с ускорением ~10-4 g для NIH/3T3 в среднем в 1,82 раза выше, а для клеток MCF-7 – в 2,27 раза выше, чем при культивировании в статичных условиях.
Пересчет регистрируемой оптической плотности в количество адгезировавшихся клеток производился с использованием разработанных калибровочных кривых (рис. 1). Видно, что калибровочная кривая MCF-7 лежит выше калибровочной кривой NIH/3T3, что указывает на то, что и метаболическая активность клеток MCF-7 выше, чем клеток NIH/3T3.
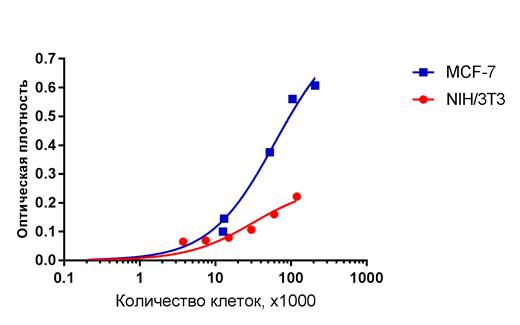
Рис. 1. Калибровочные кривые для пересчета оптической плотности в МТТ-тесте в количество заселенных клеток для линейных культур NIH/3T3 и MCF-7
Для оценки различий в относительном увеличении количества выявленных клеток для одинаковых материалов при статическом и динамическом культивировании нами было введено значение 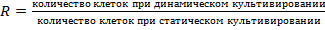 . Сравнение параметров культивирования клеток выявило умеренную корреляцию между относительным ростом R-значения и толщиной материала, коэффициент корреляции Пирсона составил r=−0,41 (p=0,045).
. Сравнение параметров культивирования клеток выявило умеренную корреляцию между относительным ростом R-значения и толщиной материала, коэффициент корреляции Пирсона составил r=−0,41 (p=0,045).
Разделение материалов на две подгруппы − толщиной менее 250 мкм и более 250 мкм - сделало возможным проведение двухфакторного дисперсионного анализа, сравнив относительное увеличение количества заселенных клеток NIH/3T3 и MCF-7 для материалов различной толщины (рис. 2).
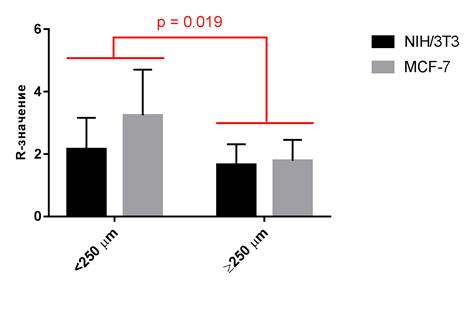
Рис. 2. Результаты двухфакторного дисперсионного анализа R-значений для типа клеток (NIH/3T3 или MCF-7) и толщины материала (<250 мкм или ≥250 мкм)
R-значение в подгруппе материалов толщиной ≥250 мкм уменьшилось на 30% от значения в подгруппе более тонких материалов (p=0,019), что говорит о снижении выявленного количества заселенных на такие материалы клеток. Сравнение R-значений между подгруппами клеток выявило, что толщина материала оказывает на клетки MCF-7 более выраженный эффект, однако данное различие не было статистически значимым (p=0,13).
Обсуждение
В настоящей работе нами показано, что толщина материала более чем 250 мкм оказывает влияние на результаты стандартного МТТ-теста (p=0,019). При этом данный эффект оказывает более выраженное влияние на эпителиальную культуру MCF-7 (p=0,13), что может объясняться как большей подвижностью эпителиальноподобных клеток и их лучшим проникновением в глубину высокопористого материала, так и выявленной нами их большей метаболической активностью.
Корреляция выявляемой в МТТ-тесте метаболической активности с количеством заселенных клеток ранее была показана как для NIH/3T3 [6], так и для MCF-7 [7], однако количественная оценка заселения клеток на трехмерные матриксы остается обсуждаемой проблемой, поскольку материал каркаса может влиять на оценку жизнеспособности, замедляя диффузию реагентов внутрь или наружу каркаса, взаимодействуя с реагентами и влияя на результаты анализа [8]. В современных исследованиях отмечается, что в случае повышенного проникновения клеток в структуру волокнистой конструкции необходимо использование модифицированного МТТ-теста (растворение конструкции каркаса до солюбилизации образовавшегося формазанового красителя) при толщине конструкций порядка 1 мм [9; 10]. В противном случае мигрировавший вглубь материала объем клеток остается незаметным, а замерам подвергаются клетки на поверхности конструкции. Особенно это относится к клеткам эпителиального фенотипа с высоким потенциалом к миграции вдоль волокон матрикса при длительном культивировании.
Выбор растворителей зависит от состава микроволокнистого материала, при этом основным требованием к растворителям является нейтральность к формазановому красителю. Обобщение характеристик растворителей различных синтетических материалов, использующихся для электроформования микроволокнистых каркасов, приведено в таблице.
Параметры растворителей полимерных материалов, использующихся для электроформования микроволокнистых материалов [11]
|
Полимер |
Растворитель |
Концентрация |
|
поликапролактон (ПКЛ) |
90% хлороформ / 10% метанол |
0,12 г/мл |
|
полилактид (ПЛА) |
1,1,1,3,3,3-гексафтор-2-пропанол |
0,15 г/мл |
|
полигликолид (ПГА) |
1,1,1,3,3,3-гексафтор-2-пропанол |
0,10 г/мл |
|
поли(лактид-со-гликолид) (ПЛГА) |
1,1,1,3,3,3-гексафтор-2-пропанол |
0,35 г/мл |
|
40% диметилформамид / 60% тетрагидрофуран 60% диметилформамид / 40% хлороформ |
0,1 г/мл 0,3 г/мл |
|
|
поли(лактид-со-капролактон) (ПЛК) |
70% N,N-диметилформамид / 30% дихлорметан |
10% масс. |
Дальнейшая разработка протоколов оценки цитосовместимости требует изучения характера взаимодействия растворителей с формазановым красителем при проведении модифицированного МТТ-теста. При этом на параметры протоколов при исследовании композитных материалов влияние может оказать химический состав сополимеров и степень кристалличности.
Другие современные методы оценки жизнеспособности клеток, например PrestoBlue (Invitrogen) на основе восстановления ресазурина, позволяют проводить исследование без стадий растворения кристаллического осадка. Теоретически такие методы прижизненной окраски могут быть пригодны для прямого измерения жизнеспособности клеток, заселенных на 3D-материалы, однако это требует дополнительного изучения взаимодействия растворителей с формазановым красителем при проведении МТТ-теста.
Заключение
Выполнение анализа жизнеспособности клеток на объемных высокопористых матриксах с использованием МТТ-теста может приводить к занижению действительных значений количества адгезированных клеток и требует подготовки, отличной от стандартного протокола анализа клеточных культур, заселенных на плоские поверхности. Оценка метаболической активности клеток, заселенных на микроволокнистые синтетические каркасы, может потребовать использования модифицированного МТТ-теста с включением этапа растворения конструкции каркаса до солюбилизации образовавшегося формазанового красителя. Данная модификация требует предварительного подбора соответствующих растворителей для каждого полимера или комбинации растворителей в случае использования композитных материалов. Для изучения взаимодействия растворителей с формазановым красителем при проведении МТТ-теста требуются дальнейшие исследования.
Настоящее исследование выполнено с использованием оборудования ЦКП «Регенеративная медицина» (ID 310020) и УНУ (506197) Первого МГМУ им. И.М. Сеченова Минздрава России. Микроволокнистые полимерные материалы были созданы, охарактеризованы и предоставлены лабораторией полимерных материалов НИЦ «Курчатовский институт» (зав. лабораторией проф. Чвалун С.Н., к.х.н. Тенчурин Т.Х., к.х.н. Шепелев А.Д.).



