Существует предположение, что иммунологические дезинтеграции имеют существенное значение в возникновении многочисленных болезней [1, 2]. В последнее время амилоидоз рассматривается как заболевание, в основе которого лежат нарушения в системе иммуногенеза, в результате чего во внутренних органах откладываются белки, имеющие фибриллярную структуру, состоящие из легких цепей иммуноглобулинов. По градации белка-предшественника различают следующие разновидности: AL-, AА- и ATTR-амилоидоз [1-3]. В литературе описано и изучено 36 амилоидных белков в человеческом организме, из которых 14, очевидно, ассоциированы непосредственно с системным амилоидозом, 19 – с локальным, а 3 белка – как с локальным, так и с системным амилоидозом [2, 3]. Как правило, системный характер амилоидного поражения органов поздно диагностируется в связи с плохой распознаваемостью процесса вследствие многоликости его симптоматики. Основной структурой амилоидного депозита являются фибриллярные структуры, имеющие диаметр 5–10 нм и длину до 800 нм, состоящие из нескольких разнонаправленных филаментов, которые образуют кросс-бета-складчатую конфигурацию. Именно эта конфигурация обусловливает типичное оптическое свойство амилоидных отложений – наличие двойного лучепреломления.
Прогрессирование амилоидоза способствует развитию гибели органоспецифических структур и вытеснению их соединительной тканью, что приводит к нарушению структурно-функциональной дезинтеграции органа [1, 2, 3]. Повсеместно развитие амилоидоза имеет бессимптомное, а в некоторых случаях – малосимптомное течение, и его идентификация зависит от морфологической дифференцировки фибриллярного белка в биопсийном материале. Таким образом, ранняя диагностика амилоидоза в практической деятельности врачей имеет значительные сложности в результате отсутствия обобщенного патоморфологического и клинического материала и отсутствия каких-либо специфических симптомов, неполноценной осведомленности и настороженности специалистов в отношении этой тяжелой патологии. Часто затрудняется дифференцированный диагноз между циррозом печени, гемобластозами и системным амилоидозом [4, 5, 6, 7]. В связи с этим данный клинико-морфологический случай интересен и актуален для специалистов широкого профиля.
Цель исследования – патоморфологическое описание органов (сердца, печени, почек, селезенки) при системном AL-амилоидозе.
Материал и методы исследования. Проведен анализ полученной сопроводительной медицинской документации (амбулаторной карты пациента, истории болезни). Применена стандартная методика патологоанатомического вскрытия. Использованы гистологические методы исследования: гематоксилин-эозин, конго-позитивное окрашивание срезов органов, иммуногистохимическое типирование амилоида с моноклональными антителами к фибриллярному белку-амилоиду.
Результаты исследования и их обсуждение. На секционное исследование был доставлен труп женщины 57 лет, которая находилась на стационарном лечении в реанимационном отделении одной из больниц города Чебоксар с диагнозом: Цирроз печени. Портальная гипертензия. Реканализация пупочной вены. Асцит. Двусторонний гидроторакс.
Согласно медицинской документации известно, что пациентка поступила с жалобами на недомогание, быструю утомляемость, болевой синдром в правом подреберье, увеличение объема живота, отечность нижних конечностей. Из анамнеза известно, что пациентка себя считает больной в течение 3 месяцев, когда появились вышеперечисленные жалобы. В течение 1 месяца находилась на стационарном лечении в терапевтическом отделении с диагнозом: Криптогенный цирроз печени. После выписки отмечалось ухудшение состояния, когда появились тошнота, многократная рвота, понижение артериального давления до 60/30 мм рт. ст., вследствие этого была вновь госпитализирована.
При объективном осмотре выявлены крайне тяжелое состояние, двигательная и мыслительная заторможенность, иктеричность склер, наличие пальмарной эритемы в области обеих ладоней, что указывало на возникновение геморрагического синдрома, протекающего на фоне печеночно-клеточной недостаточности. Выявлены трофические изменения кожи, отеки голеней и стоп. Проведены лабораторные исследования: общий анализ крови, где отмечался умеренный лейкоцитоз – 13,56 109/л, эритроцитоз – 7,18 (3,91–5,31)1012/л, повышение гемоглобина до 158 (в норме показатели варьируют от 111 до 147) г/л, признаки выраженного нейтрофилеза (12,80 (1,50–5,00)109/л, процент нейтрофилов: 87,0 (в норме 40,2–71,4)%), при одновременной лимфоцитопении (процент лимфоцитов составил 12,0%). Остальные показатели крови были в допустимых пределах. В общем анализе мочи выявляли протеинурию, эритро- и лейкоцитурию в ассоциации с нарастающей азотемией. На основании представленных анализов очевидно, что развивался нефротический синдром с нарушением азотовыделительной функции почек.
В динамике через 2 дня при проведении биохимического анализа крови выявлена отрицательная динамика: мочевина – 28,5 (норма 2,8–8,3) ммоль/л, креатинин – 218,8 (норма 44,0–106,0) мкмоль/л; билирубин общий – 380,2 (норма 2,0–21,0) мкмоль/л, показатели прямого билирубина достигали 125,1 (допустимые пределы 0,1–5,1) мкмоль/л, щелочной фосфатазы – до 1598,7 (допустимые пределы 30,0–120,0) Ед/л, АлАт – 90,4 (норма 1,0–45,0) Ед/л, AсАт – 228,6 (норма 1,0–35,0) Ед/л, гамма-глутамилтранспептидаза – 616,5 (норма 1,0–38,0) Ед/л.
При проведении инструментальных методов исследования на электрокардиограмме выявлены неспецифические признаки амилоидного поражения сердечной мышцы: отмечены признаки низкого вольтажа QRS, недостаточного нарастания зубцов R; неполной блокады левой ветви пучка Гиса. При ультразвуковом исследовании органов брюшной полости обнаружены признаки множественных кист на фоне увеличения и диффузных изменений печени, поджелудочной железы, реактивного утолщения стенки желчного пузыря, асцита, двухстороннего гидроторакса, а также эхо-признаки портальной гипертензии, фрагментарного неполного тромбоза основного ствола и правой долевой воротной вены, реканализации пупочной вены.
Проведенное симптоматическое лечение включало: гепатопротекторы, поляризующую смесь, антикоагулянтные средства. Внезапно состояние ухудшилось, проводимые реанимационные мероприятия были неэффективны, и была констатирована биологическая смерть.
При секционном исследовании обнаружены признаки, характерные для системного AL-амилоидоза, с вовлечением в процесс сердечной мышцы, печени, почек, селезенки. При макроскопическом исследовании органов наблюдалось их увеличение, на разрезах – серо-коричневый цвет, плотная консистенция, сальный блеск (рис. 1). Селезенка размерами 11,0х5,0х4,0 см.
А. 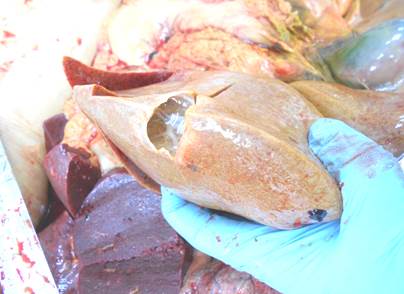
Б. 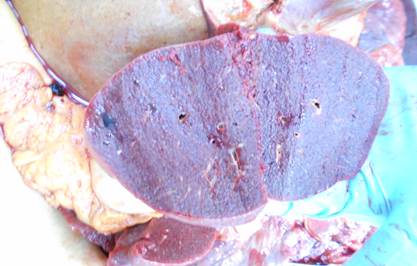
Рис. 1 А, Б. Амилоидоз печени (сальная печень, макроскопическая картина)
При гистологическом исследовании сердца определялись участки с обширным замещением кардиомиоцитов эозинофильными однородными белковыми массами (амилоид) (рис. 2), также имелись межуточный отек, очаговая гипертрофия кардиомиоцитов.
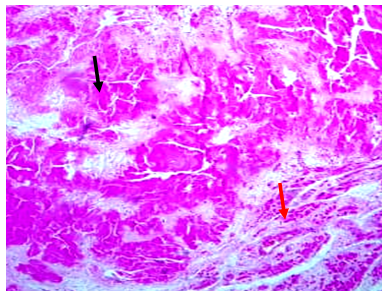
Рис. 2. Амилоидные отложения (черная стрелка) и кардиомиоциты в состоянии атрофии (красная стрелка). Окраска конго красным, х200
В почках выявлены отечные клубочки с очаговым склерозированием. В капсуле Шумлянского–Боумена имелись эозинофильные массы. Эпителий проксимальных и дистальных извитых канальцев местами десквамирован, в их просвете эозинофильные депозиты. Выявлены конго-позитивные, амилоидные массы с типичным проявлением анизотропии и дихроизма в поляризованном свете.
В печени отмечалось нарушение балочного строения, преимущественно за счет выраженного накопления в гепатоцитах эозинофильного белка (амилоида), часть гепатоцитов подверглась атрофическим изменениям (рис. 3). Обнаружен перипортальный склероз с пролиферацией эпителия желчных протоков. В селезенке амилоидные массы располагались преимущественно в лимфоидных фолликулах, сосудах, строме.
С целью идентификации белка-предшественника амилоидного поражения использовались иммуногистохимические методы с антителами к κ, λ, амилоидым массам, преамилоиду, преальбумину, Р-компоненту. Выявленная экспрессия Р-компонента и дисбаланс между κ и λ (1:9) удостоверили плазмоклеточную дискразию. Отсутствие симптомов миеломного поражения, заболевания Вальденстрема и других В-клеточных неоплазм позволило идентифицировать первичное амилоидное поражение внутренних органов.
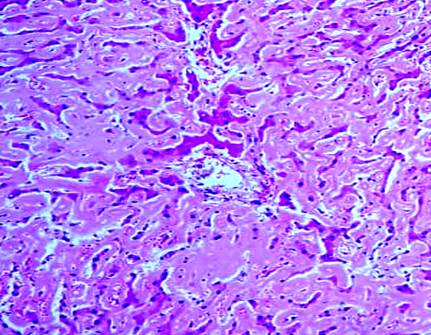
Рис. 3. Диффузные амилоидные депозиты в строме печеночных долек с атрофией печеночных клеток, слабой лимфогистиоцитарной инфильтрацией. Окраска гематоксилином и эозином, х200
Выявлялись признаки отечно-асцитического синдрома: развитие асцита (4300 мл), двустороннего гидроторакса (по 250 мл с обеих сторон), гидроперикарда (50 мл), отечность голеней и стоп.
Определялись признаки полиорганной недостаточности, макроскопическая картина характерна для отека головного мозга с вклинением миндалин мозжечка в большое затылочное отверстие, гистологически выявлялся перицеллюлярный и периваскулярный отек. Также выявлялся отек легких, пальпаторно легкие неравномерно были уплотнены, макроскопически – легкие повышенной влажности и кровенаполнения, с поверхности разрезов стекала пенистая жидкость в большом количестве, гистологически – в альвеолах наблюдались отечный экссудат, лимфомакрофагальная инфильтрация и полнокровие сосудов.
Таким образом, непосредственным механизмом летального исхода явились мозговой танатогенез (отек головного мозга с вклинением миндалин мозжечка в большое затылочное отверстие) и острая сердечно-сосудистая недостаточность.
Выставлен патоморфологический диагноз: Основное заболевание: системный AL-амилоидоз с поражением сердца, печени, почек, селезенки. Осложнения: отечно-асцитический синдром. Печеночно-почечная недостаточность. Паренхиматозная желтуха. Печеночная энцефалопатия. Отечная жидкость в легких и головном мозге с вклинением миндалин мозжечка в большое затылочное отверстие.
Заключение. Представленный случай демонстрирует трудности прижизненной верификации системного AL-амилоидоза. Однако при дифференцировке клинических и инструментальных параметров можно предположить развитие амилоидного поражения в органах: в сердечной мышце с помощью электрокардиографии выявлялись признаки нарушений сердечного ритма, изменения вольтажа зубцов [6-8].
По патологоанатомическим данным можно сделать заключение, что основным заболеванием пациентки явился системный AL-амилоидоз, который проявился хронической почечной, печеночной и острой сердечно-сосудистой недостаточностью. Первичные клинико-морфологические симптомы печеночно-клеточной недостаточности и портальной гипертензии сопровождались признаками, схожими с циррозом печени, за счет того, что амилоидные отложения имели интралобулярный и диффузный характер с развитием атрофических изменений в печеночных клетках. При аутопсии печень была значительно увеличенной в размерах (спленомегалия), плотной консистенции, имеющей сальный блеск на разрезе и на поверхности. Выраженного воспалительного процесса и цирротического поражения не было выявлено, а определялись диффузно расположенные амилоидные депозиты, что достоверно подтверждало диагноз амилоидоза. Как правило, отмечались изменения в биохимическом анализе: в десятки раз увеличивались показатели гамма-глутамилтранспептидазы и щелочной фосфатазы.
Кроме того, у больной амилоидное поражение почек сопровождалось выраженной протеинурией с длительным прогрессирующим характером (увеличивался креатинин, нарушалась азотовыделительная функция почек). Амилоидные отложения в кардиомиоцитах привели к нарушению межклеточных контактов и возникновению острой сердечно-сосудистой недостаточности, которая постепенно прогрессировала и привела к развитию систолической дисфункции и застойным явлениям. Амилоидное поражение почек и сердца очевидно привело к возникновению отека легких, гипоксическому состоянию, структурно-функциональной дисфункции.
Следует отметить, что своевременная морфологическая диагностика амилоидного поражения (в биопсийном материале) предполагает не только обнаружение, но и необходимое типирование амилоидного белка, что требуется при назначении специфического лечения.
Представленный клинико-морфологический случай показывает, что амилоидный процесс нужно учитывать в рамках дифференциальной диагностики и целенаправленно обследовать больных с неспецифическими и длительными симптомами полиорганной патологии.



