Рак молочной железы (РМЖ) является самой актуальной проблемой в онкологической заболеваемости женщин. Предложено множество различных методов лечения. В последние годы активно используется ВОЛТ (внутриоперационная лучевая терапия) в комбинации с хирургическим лечением, что позволяет сохранить орган и провести реконструкцию молочной железы. Термин ВОЛТ в настоящее время используется для различных методик, которые показывают огромные различия в доставке дозы и охвате ткани, подверженной риску. Наибольшие доказательства эффективности ВОЛТ при РМЖ, предшествующей облучению всей груди, получены при интраоперационном электронном лечении (ИОЭЛТ) с разовыми дозами около 10 Гр [1].
Лучевая терапия во время операции позволяет подводить небольшие дозы облучения и полностью щадить кожу, что положительно сказывается на поздней переносимости тканей и, следовательно, на косметическом внешнем виде. При этом уменьшается частота появления сером и гематом. Так называемая «Boost» (ускорение), или ускоренная ВОЛТ, незначительно продлевает хирургическую процедуру по времени, в то же время значительно сокращает послеоперационную лучевую терапию. Операция по сохранению молочной железы с последующим послеоперационным облучением всей молочной железы является современным стандартом лечения больных РМЖ на ранних стадиях. Несколько рандомизированных исследований показали, что послеоперационная радиотерапия демонстрирует значительное преимущество в отношении онкологического исхода за счет снижения частоты рецидивов и смертности от РМЖ [2]. В Зальцбургской группе вообще рецидивов не отмечено, ими показано значительное преимущество интраоперационного электронного бустинга по сравнению с чрескожным бустингом в сочетании с тотальным облучением. Так, в ипсилатеральной молочной железе наблюдался отличный 5-летний контроль с частотой рецидивов 0% в груди по сравнению с 4,3% после чрескожного облучения [3].
У некоторых пациентов само ложе опухоли представляет собой область с более высокой вероятностью рецидива, поэтому дополнительная повышающая доза 10–16 Гр (5–8 × 2 Гр) значительно снижает частоту местных рецидивов и поэтому рекомендуется для более молодых пациентов или для пациентов с другими факторами риска, связанными с более высоким риском местных рецидивов [4, 5]. Для применения boost доступны различные методы, включая внешнюю лучевую терапию, интраоперационную лучевую терапию (kV-IORT) или электронную внутриоперационную радиотерапию (electron-IORT) [6].
В настоящее время выделяют различные иммунофенотипические варианты РМЖ. Существуют 4 варианта: 2 вида люминального (А и В), HER2+ и трижды негативный (ТН) молекулярные подтипы РМЖ. Люминальные типы экспрессируют рецепторы к эстрогену (РЭ) и прогестерону (РП), и в зависимости от экспрессии Hеr2/neu их классифицируют на А (не экспрессируют Hеr2/neu) и В (экспрессируют Hеr2/neu). Их называют еще эстроген-зависимыми опухолями, они встречаются наиболее часто при РМЖ (примерно в 30–45% случаев). Опухоли начинают развиваться во внутренних (люминальных) клетках, выстилающих молочные протоки.
Существуют новообразования, отрицательные по трем названным выше признакам, они относятся к тройному негативному (или базальноподобному) РМЖ. Многими исследователями показано, что люминальные типы имеют менее агрессивное течение и относительно хороший прогноз по сравнению с HER2+ и ТН РМЖ. Тройной негативный подтип связан с высокой частотой мутации BRCA1, агрессивным течением, отсутствием реакции на гормонотерапию и трастузумаб, низкой общей и безрецидивной выживаемостью [7].
Взаимодействие между иммуногистохимическими маркерами и чувствительностью опухоли к химиопрепаратам и таргетным средствам в настоящее время интенсивно изучается во всем мире, так как это позволяет проводить индивидуализированное лечение.
Цель исследования – оценка эффективности и токсичности после ВОЛТ в качестве ускоряющей лучевой терапии для пациентов с ранним РМЖ.
Материал и методы исследования. Наблюдение за пациентками с ранними стадиями РМЖ проводилось в Алматинском онкологическом центре в течение трех лет (с 01.02.2015 г. по 31.12.2017 г.). Интраоперационная лучевая терапия проведена на аппарате Эллиот-ЛИАК (аппарат Эллиот-Лиак (Легкий Интраоперационный Ускоритель) производства Италии, S.I.T. (Sordina IORT Technologies S.p.A.)). Это аппарат, который может быть интегрирован в любую операционную комнату без необходимости изменения существующей структуры операционной, без специальной радиационной защиты, без специфичных требований к конструкции операционной. Вес аппарата составляет всего 400 кг. Номинальная энергия электронного пучка составляет 12 МэВ, аппарат способен удовлетворить почти любой вид и уровень сложности радиационной терапии, при этом энергия может варьироваться в диапазоне 6, 8, 10, 12 МэВ. Количество получаемого излучения означает, что минимальное время, необходимое для проведения лечения, находится в интервале от 40 до 120 секунд. Мощность дозы составляет от 0 до 30 Гр/мин.
Нами были разработаны определенные критерии для включения в исследование: 1) возраст больных не должен был превышать 40 лет; 2) небольшой размер опухоли (T), равный или менее 2,5 см, отсутствие мультицентричного роста; 3) состояние регионарных лимфоузлов – отрицательный статус или наличие одного пораженного лимфоузла (N0 или N1); 4) иммуногистохимически выявлялся положительный рецепторный статус опухоли. Основная группа наблюдения составила 78 пациенток РМЖ с I–IIa стадией. Возраст больных колебался от 38 до 72 лет, средний возраст при этом составил 58,8±11,8 года.
До начала терапии всем пациенткам с ранними стадиями РМЖ был проведен стандартный набор исследований: общеклинические, биохимические анализы крови и мочи, исследования функций различных органов и систем, в том числе инструментальными методами.
Для гистологического исследования и морфологического подтверждения опухоли проводилась трепанбиопсия, которая была выполнена всем 78 пациенткам РМЖ. После гистологического заключения в обязательном порядке осуществлялось гистохимическое исследование, при котором определяли фенотипические варианты РМЖ. Дальнейшее лечение обсуждалось совместно специалистами с участием онколога, радиолога, хирурга и химиотерапевта. Протокол лечения основной группы пациентов, получивших комплексную терапию, был обсужден на Ученом совете Алматинского центра онкологии с участием ведущих специалистов.
По дизайну исследования оно было ретроспективным. После хирургического этапа (квандрантэктомии, секторальной резекции) по иссечению опухоли непосредственно в условиях операционной комнаты проводилось облучение операционного поля в разовой дозе (10 Гр или 21 Гр). Дозировка местного облучения зависела от фенотипа опухоли. Так, пациентки с люминальным А типом (n=40) получали 21 Гр, и им не проводилось в последующем тотальное облучение всей груди. При люминальном типе В (n=20), тройном негативном РМЖ (n=12) и Her 2 neu положительном типе (n=6) во время операции подводилась разовая доза (12 Гр). Этой группе пациенток проводилось в дальнейшем (на 10–12-е сутки) полное облучение всей пораженной груди в дозе 30–35 Гр.
Отчеты пациентов, включая диагностические исследования и токсичность, анализировались после операции и через 6–8 недель после ВОЛТ или полного облучения. Косметический эффект оценивался по 4-ступенчатой шкале Joint center for Radiation Therapy [8]. Общая и безсобытийная выживаемость рассчитывались с использованием метода Каплана–Мейера.
Результаты исследования и их обсуждение. В таблице 1 представлены клиническая характеристика пациентов с ранним РМЖ и свойства опухоли. Относительно стороны поражения – правая и левая части груди поражались опухолью примерно в одинаковых пропорциях – 53,8% и 46,2% соответственно. До операции стадия ТО не была обнаружена ни у одного пациента, однако после окончательного гистологического исследования у 3 больных была выявлена карцинома «in situ». Стадия Т1а была выявлена в 10,2% и 15,4% случаев соответственно до и после операции. Следовательно, произошло незначительное изменение стадии. При Т1b и Т1c стадия практически не изменилась. Однако при Т2 были определенные сдвиги, но в обратную сторону. Если до операции пациенткам вторую стадию выставили в 22 случаях (28%), то после – в 15 (19,3%), следовательно, имела место гипердиагностика. Такая же тенденция была отмечена при установлении статуса лимфоузлов в отношении Т0: при клиническом обследовании до операции Т0 был выставлен у 72 пациенток с РМЖ, а после – только у 64 больных. Но при анализе N1 имела место гиподиагностика – 7,7% против 16,6%. Необходимо отметить, что если до операции статус N2 не был обнаружен, то после операции данный статус был определен в одном случае.
Таблица 1
Характеристика пациентов и опухоли
|
Всего (n=78) |
n (%) |
Характеристики n (%) |
|
Средний возраст, лет (ранг) |
58 (38–72) |
|
|
Сторона |
|
|
|
Правая |
42 (53,8) |
|
|
Левая |
36 (46,2) |
|
|
T стадия |
cT |
pT |
|
T0 |
– |
3 (3,8) |
|
T1a |
8 (10,2) |
12 (15,4) |
|
T1b |
15 (19,2) |
16 (20,5) |
|
T1c |
33 (42,3) |
32 (41,0) |
|
T2 |
22 (28,0) |
15 (19,3) |
|
N стадия |
cN |
pN |
|
N0 |
72 (92,3) |
64 (78,0) |
|
N1 |
6 (7,7) |
13 (16,6) |
|
N2 |
0 (0,0) |
1 (1,4) |
|
Градация |
Биопсия |
Гистология |
|
G1 |
24 (30,8) |
21 (26,9) |
|
G2 |
40 (51,3) |
44 (56,4) |
|
G3 |
14 (17,9) |
10 (12,8) |
|
Не установлена |
– |
3 (3,8) |
|
Иммунофенотип Люминальный A Люминальный B Тройной негативный Her2+
|
40 (51,3) 20 (25,6) 12 (15,4) 6 (7,7)
|
|
Таким образом, разница между патологическим образцом в биопсийном материале по сравнению с операционным была зафиксирована у 16 из 78 пациентов (20,5%):
– повышение уровня Т-статуса наблюдалось у 4 пациентов (5,1%). Снижение отмечалось у 8 (10,2%) пациентов. У остальных 66 пациентов (84,6%) изменения Т-статуса не наблюдалось;
– повышение уровня N-статуса наблюдалось у 5 (6,4%) пациентов, из которых 1 (1,3%) получили неоадьювантную химиотерапию. Понижение произошло у 6 (7,7%) пациентов, из которых 4 (5,1%) получили предоперационную химиотерапию. У остальных пациентов сдвиг стадии не наблюдался.
При облучении во время операции на место ложа опухоли (удаленный участок опухоли) прикладывали специальные аппликаторы (рис. 1).
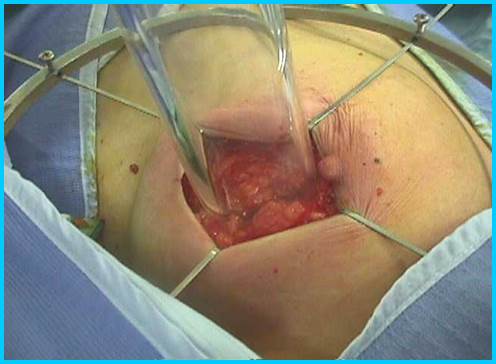
Рис. 1. Наложение аппликатора для проведения интраоперационной лучевой терапии
В таблице 2 представлена характеристика больных РМЖ по видам лечения. Всем пациенткам проведены ИОЛТ и сохранная операция в виде резекции груди с различными видами пластики. Больным с ТН РМЖ в предоперационном периоде проведена химиотерапия, в основном с антрациклинами (n=14). Некоторым пациенткам при выявлении подозрительных лимфоузлов в региональных зонах (подмышечной) выполнена подмышечная лимфодиссекция (n=12).
Таблица 2
Характеристика лечения
|
Всего n=78 |
n |
% |
|
Органосохранная операция |
78 |
100,0 |
|
Подмышечная лимфаденоэктомия |
12 |
15,4 |
|
Неоадьювантная химиотерапия |
14 |
17,9 |
|
Адьювантная химиотерапия |
18 |
23,1 |
|
Адьювантная гормонотерапия |
75 |
96,1 |
|
Дистанционная лучевая терапия пораженной груди |
38 |
46,8 |
|
Интраоперационная лучевая терапия |
78 |
100,0 |
Примерно половина больных (46,8%) получили дистанционную лучевую терапию на пораженную грудь. Это были пациентки с ранним РМЖ, фенотипически представленным люминальным В типом, тройным негативным РМЖ и Her-2 положительным статусом. Дистанционная лучевая терапия была проведена на всю пораженную грудь после ВОЛТ и хирургического этапа в суммарной дозе 30–35 Гр. Метод фракционирования был обычный.
После окончания ВОЛТ у части пациенток РМЖ наблюдались побочные эффекты или осложнения, описываемые при проведении данной процедуры. Разрастание соединительной ткани (фиброзные изменения) тяжелой степени после ВОЛТ в нашем наблюдении не описаны. Однако фиброз легкой степени или незначительной выраженности был выявлен в двух случаях (2,6%). Описываемые в литературе некротические изменения тканей молочной железы в нашем исследовании не наблюдались. Гематома в области послеоперационной раны часто отмечается среди побочных эффектов ВОЛТ и операции. Этот вид осложнений был также редким и встречался в одном случае (1,3%). Также в одном случае было отмечено рубцевание кожи (1,0%). Из воспалительных процессов у 2 больных развились раневые инфекции, не требующие хирургического вмешательства (2,6%), и им проводилась противовоспалительная терапия (антибиотики). Таким образом, частота осложнений была невысокой и вполне допустимой при проведении подобных процедур и вмешательств. Общая частота таких осложнений составила 7,6%.
Медиана наблюдения составила 33,6 месяца. Местного рецидива рака и прогрессирования заболевания или продолженного роста опухоли не было. После данной методики были отмечены прекрасные и хорошие косметические результаты (полная или незначительная асимметрия молочных желез) в 55 (70,5%) случаях, удовлетворительные (выраженная асимметрия, лучевые повреждения кожи 2-й степени) в 23 (29,5%) случаях. Неудовлетворительных исходов (таких как значительная асимметрия, лучевые повреждения кожи 2-й или 4-й степени) выявлено не было. На момент окончания наблюдения за больными пациентов с летальным исходом не было. Общая выживаемость составила 100,0%. Безсобытийная выживаемость, где событием явились местный рецидив или смерть, к моменту окончания исследования также составила 100%.
Заключение
Основной целью данного анализа была оценка эффективности и токсичности после ВОЛТ в качестве ускоряющей лучевой терапии для пациентов с ранним РМЖ, получавших лечение в нашем учреждении. Исследование продемонстрировало, что ВОЛТ является безопасным методом лечения с отсутствием или очень умеренными побочными эффектами. Токсичность тяжелой степени не обнаружена. Тем не менее в литературе описаны высокая частота серомы, инфекции или раневых осложнений после ВОЛТ по сравнению только с хирургическим лечением. Показатель образования серомы согласуется с результатами нашего исследования. Однако у большинства наших пациентов не было выявлено раневой инфекции или замедленного заживления ран, поэтому показатели образования серомы сопоставимы с литературными данными. Другие авторы также не отмечают повышения частоты образования сером даже после увеличения дозы интраоперационного облучения. Таким образом, ВОЛТ в качестве бустера является безопасной и хорошо переносимой терапией без увеличения частоты периоперационных осложнений. Более того – эта методика позволяет снизить или предотвратить частоту местных рецидивов, что очень важно с онкологической позиции.



