В настоящее время важное место в клинической практике занимает проблема гепатотоксичности нестероидных противовоспалительных препаратов (НПВП). Многие специалисты приходят к выводу об очевидной взаимосвязи поражения печени с приемом НПВП [1–3]. Карпрофен относится к селективным НПВП, влияет преимущественно на фермент циклооксигеназу-2 (ЦОГ-2). Имеются сведения, что при применении карпрофена у животных наблюдается развитие побочных эффектов со стороны желудочно-кишечного тракта, меньше информации имеется о гепатотоксическом действии карпрофена [4].
В научной литературе имеется описание нескольких механизмов лекарственного поражения печени: прямое токсическое действие препарата, токсическое действие метаболитов лекарственных средств, а также иммунные и аллергические поражения [5]. Исследования, посвященные данной проблеме, выявили отдельные механизмы повреждения органа на клеточном и субклеточном уровнях. Особый интерес в патогенезе НПВП-гепатопатии представляет участие цитокинов, вовлеченных в различные патофизиологические реакции, – интерлейкина-2 (ИЛ-2) и фактора некроза опухоли α (ФНО α).
Известно, что ФНО α выступает в качестве одного из основных регулирующих белков на этапах формирования воспаления и иммунного ответа, избыточная продукция этого цитокина вызывает токсический эффект у клеток тканей [6, 7]. Таким образом, изучение данного аспекта патогенеза НПВП-индуцированной гепатопатии позволит расширить понимание факторов риска при данной патологии.
Цель исследований – изучение и количественная оценка экспрессии рецепторов цитокинов: интерлейкина-2 и фактора некроза опухоли α – в паренхиме печени у экспериментальных моделей (крыс) с НПВП-гепатопатией, индуцированной длительным приемом карпрофена в различных дозировках.
Материалы и методы исследования. Для иммуногистохимических исследований использовали образцы печени, полученные от нелинейных белых крыс (самцов и самок c массой тела 200–250 г) с моделированной НПВП-гепатопатией. В соответствии с целью исследований в течение 21 дня животным вводили карпрофен (Римадил Р, Pfizer Animal Health, США) per os 1 раз в день за 1 час до кормления. Опытным группам применяли препарат в дозах: 4 мг/кг (терапевтическая доза, n=26); 8 мг/кг (n=28), 20 мг/кг (n=22), 40 мг/кг (n=24). Для сравнительного контроля использовали интактных животных (n=21).
Исследования проводили в соответствии с «Правилами лабораторной практики в Российской Федерации» (утверждены приказом Министерства здравоохранения РФ № 708 от 23 августа 2010 г.) и «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18 марта 1986 г.
Для изучения иммуногистохимической экспрессии рецепторов интерлейкина-2 (IL-2Rα) и фактора некроза опухоли α (TNFαR1) использовали антитела TNFR1 (poly) 100 μl, bs-2941R, Rabbit Anti-TNF Receptor I Polyclonal Antibody (Bioss) и IL-2Rα (poly) 1 ml (М-19), sc-666 (Santa Cruz Biotechnology, INC), видоспецифичные к антигенам тканей крысы. Антитела выявляли при использовании системы детекции Uno Vue detection system (100 tests, UMR 100PD); для изготовления препаратов использовали стекла с полилизиновым покрытием Menzel.
Препараты просматривали на светооптическом уровне, положительный результат идентифицировали по коричневому окрашиванию. Проводили полуколичественную оценку экспрессии по двум критериям. В «крестах» оценивали интенсивность окрашивания: от слабоположительной (+) до резко положительной (++++); незначительное очаговое окрашивание оценивали как «+» [8]. В баллах оценивали число позитивно окрашенных клеток: 2 балла – до 20%, 4 балла – от 20 до 40%, 6 баллов – более 40% клеток [9]. Достоверность различий результатов определяли по t-критерию Стьюдента.
Результаты исследования и их обсуждение. Предварительно были проведены гистологические исследования, в которых выявили морфологические нарушения паренхимы печени. Из обнаруженных нарушений наиболее распространенными были сосудистые расстройства, которые проявлялись полнокровием центральных вен печеночных долек и расширением синусоидных капилляров, они обнаруживались у всех животных опытных групп, получавших разные дозировки карпрофена. У групп, получавших дозы препарата выше терапевтической, наблюдалось полнокровие сосудов междольковых триад.
Зернистая дистрофия гепатоцитов проявлялась у животных всех опытных групп. У группы, получавшей пятикратную дозировку карпрофена, в единичных клетках наблюдались признаки вакуольной и крупнокапельной жировой дистрофии гепатоцитов. На участках паренхимы печени наблюдались ограниченные некрозы, вокруг некрозов визуализировались очаги регенерации гепатоцитов [10]. Следовательно, длительный прием карпрофена вызывал патоморфологические изменения в печени, характерные для токсического поражения.
Оценку экспрессии рецепторов интерлейкина-2 (IL-2Rα) и фактора некроза опухоли α (TNFαR1) в паренхиме печени проводили по интенсивности окрашивания, которая характеризует интенсивность экспрессии рецепторов цитокинов, и по числу окрашенных клеток (количественная характеристика действия цитокинов на печень).
Экспрессия IL-2Rα. Просмотр гистологических препаратов показал, что в ткани печени у интактных животных клетки наблюдались единичные позитивно окрашенные клетки, что оценивалось на 1,82±0,11 балла (табл. 1).
Таблица 1
Оценка экспрессии IL-2Rα в печени экспериментальных животных
|
Группа животных |
Полуколичественная оценка |
|
|
В «+» (интенсивность окрашивания) |
В баллах (число позитивно окрашенных клеток) |
|
|
Интактных |
± |
1,82±0,11 |
|
Получавших дозу 4,0 мг/кг |
+++ |
4,87±0,64* (р=0,000) |
|
Получавших дозу 8,0 мг/кг |
++++ |
5,48±0,92* (р=0,001) |
|
Получавших дозу 20,0 мг/кг |
+++ |
4,53±0,48* (р=0,000) |
|
Получавших дозу 40,0 мг/кг |
++ |
3,56±0,29* (р=0,000) |
* p<0,05 по сравнению с животными контрольной группы.
Во всех опытных группах (различающихся дозировками карпрофена) паренхима печени и часть желчных протоков портальных трактов были иммунопозитивны к IL-2Rα (рис. 1). Увеличивалось число IL-2Rα-позитивных клеток: наибольшее увеличение было в группе, получавшей двукратную дозу, – в 3 раза (p<0,05), а в группе, получавшей десятикратную дозу, – приблизительно в 2 раза (p<0,05).
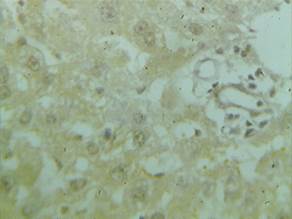
Рис. 1. Экспрессия IL-2Rα в паренхиме печени животного, получавшего карпрофен в дозе 40,0 мг/кг, х600
Интенсивность экспрессии IL-2Rα между группами отличалась (табл. 1). Наиболее выраженной она была у животных, получавших двукратную дозу карпрофена (++++), наименьшей – в группе, получавшей десятикратную дозу (++).
Экспрессия TNFαR1. У интактных животных TNFαR1-позитивные клетки наблюдались в качестве единичных гепатоцитов и клеток эпителия желчных протоков портальных трактов, что составило 1,79±0,14 балла (рис. 2, табл. 2).
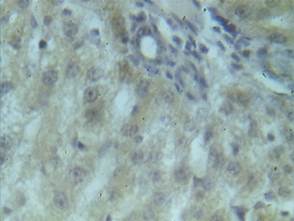
Рис. 2. Иммунонегативная к TNFαR1 паренхима печени интактного животного, х600
Таблица 2
Оценка экспрессии TNF-αR1 в печени экспериментальных животных
|
Группа животных |
Полуколичественная оценка |
|
|
В «+» (интенсивность окрашивания) |
В баллах (число позитивно окрашенных клеток) |
|
|
Интактных |
+ |
1,79 ± 0,14 |
|
Получавших дозу 4,0 мг/кг |
+++ |
5,93±0,54* (р=0,000) |
|
Получавших дозу 8,0 мг/кг |
++++ |
5,98±0,67* (р=0,000) |
|
Получавших дозу 20,0 мг/кг |
++ |
5,81±0,74* (р=0,000) |
|
Получавших дозу 40,0 мг/кг |
++ |
5,73±0,56* (р=0,000) |
* p<0,05 по сравнению с животными контрольной группы.
У животных всех опытных групп, получавших карпрофен, наблюдалось иммунопозитивное окрашивание как гепатоцитов, так и большей части желчных протоков портальных трактов (рис. 3). Во всех группах приблизительно в 3,7 раза (p<0,05 по сравнению с интактными животными) увеличивалось количество окрашенных клеток в паренхиме печени. Высокая степень окрашивания (++++) наблюдалась в группе животных, получавших карпрофен в двукратной дозировке (рис. 3). Значительно меньше (++) была окраска паренхимы печени у крыс, получавших пяти- и десятикратную дозы.
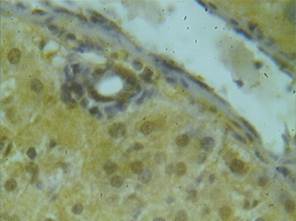
Рис. 3. Экспрессия TNFαR1 в паренхиме печени животного,
получавшего карпрофен в дозе 8,0 мг/кг массы тела, х150
Выявленное нами повышение экспрессии рецепторов цитокинов в печени у экспериментальных животных демонстрирует участие интерлейкина-2 (ИЛ-2) и фактора некроза опухоли (ФНО α) в развитии НПВП-гепатопатии, индуцированной длительным приемом карпрофена.
Данные исследований, представленные в научной литературе, показывают, что болезни печени развиваются при участии ряда цитокинов, таких как ФНО α, ИЛ-2, ИЛ-6, при этом ФНО α играет ключевую роль [11, 12]. В исследованиях на экспериментальных моделях мышей было продемонстрировано участие ФНО α в индукции развития аутоиммунного гепатита, причем применение ингибиторов ФНО α препятствовало его развитию [6].
ФНО α синтезируется несколькими типами клеток (преимущественно макрофагами), он участвует во многих клеточных процессах (плейотропное действие). Действие ФНО α на клеточные реакции осуществляется через специфические рецепторы, локализующиеся на мембране клетки.
В литературе описаны пять сигнальных путей, через которые ФНО α реализует свое действие на клетку [6, 7]. Активация апоптоза происходит, когда ФНО α воздействует на клетку-мишень через рецептор TNFαR1, экспрессирующийся на ее поверхности. В структуре рецептора имеется внутриклеточный домен смерти (DD). При взаимодействии ФНО α с рецептором активируется TNFR-ассоциированный белок домена смерти (TRADD), затем сигнал переходит на Fas-ассоциированный с доменом смерти белок (FADD), который в свою очередь активирует внутриклеточные каспазы-8 и каспазы-3, это приводит к апоптозу клетки [6].
Проявляющая экспрессия TNFαR1 свидетельствует о готовности гепатоцитов к апоптозу, обусловленному действием цитокина. В представленных нами результатах исследований показано, что проявления экспрессии TNFαR1 обнаруживались у животных, получавших препарат начиная с терапевтической дозы.
Предполагается, что иммунные реакции при лекарственных гепатопатиях могут быть обусловлены продуктами метаболизма, которые образуются в результате соединения лекарственного препарата с гемсодержащим цитохромом P450, а затем в виде везикул мигрируют к клеточной оболочке; эти соединения могут вызывать иммунный ответ в виде воздействия на клетку цитолитических Т-лимфоцитов и цитокинов [5].
По-видимому, экспрессия IL-2Rα в паренхиме печени при длительном приеме карпрофена может быть объяснена наличием аутоиммунных механизмов. ИЛ-2 синтезируется Т-лимфоцитами в ответ на стимуляцию антигенами. Он усиливает пролиферацию регуляторных Т-лимфоцитов (T-reg клеток) и экспрессию соответствующих для ИЛ-2 рецепторов [13]. Таким образом, ИЛ-2 играет основную роль в регуляции Т-клеточного ответа и является медиатором иммунитета.
Действие IL-2 осуществляется через гетеротримерный комплекс рецептора, состоящий из трех субъединиц: рецептор интерлейкина-2 α (CD25), рецептор интерлейкина-2 β (CD122) и рецептор интерлейкина-2 γ (CD132). IL-2Rα (CD25, α-цепь рецептора) конститутивно экспрессируется на T-reg клетках, которые ассоциированы с различными аутоиммунными заболеваниями [14].
Анализ полученных результатов исследований показал, что экспрессия TNFαR1и IL-2Rα в печени повышалась у животных, получавших карпрофен уже в терапевтической дозировке, но наиболее выраженной она была в группе у животных, получавших двукратную дозу препарата. Таким образом, проявления экспрессии TNFαR1и IL-2Rα имели дозозависимый характер.
У животных в группах, которым вводили пяти- и десятикратную дозу карпрофена, степень экспрессии рецепторов снижалась. Аналогичная закономерность иммуногистохимических изменений в печени наблюдалась нами ранее, при моделировании НПВП-гепатопатии, индуцированной приемом нимесулида [15]. Такая ситуация может быть обусловлена большей морфологической сохранностью печени у животных, получавших невысокие дозы препарата, тогда как низкая степень экспрессии TNFαR1 у животных, получавших пяти- и десятикратную дозу препарата, может быть связана с повреждением клеточной мембраны гепатоцитов и наличием обширных некрозов, развитие которых может происходить из-за прямого токсического действия карпрофена на печень.
Заключение. Результаты проведенных исследований продемонстрировали участие интерлейкина-2 и фактора некроза опухоли α (иммунных компонентов) в патогенезе НПВП-гепатопатии, индуцированной длительным приемом карпрофена. Повышение экспрессии TNFαR1 свидетельствует о готовности гепатоцитов к апоптозу, обусловленному действием фактора некроза опухоли α. Экспрессия IL-2Rα в паренхиме печени может быть объяснена наличием аутоиммунных механизмов при НПВП-гепатопатии.
При анализе результатов обнаружено, что степень проявления экспрессии IL-2Rα и TNFαR1 имеет дозозависимый характер. Наибольшая экспрессия отмечалась у животных, получавших двукратную дозу карпрофена, что может быть связано с большей морфологической сохранностью печени. У животных, получавших высокие дозы препарата, снижение экспрессии может быть обусловлено повреждением мембраны гепатоцитов и развитием некрозов.



