В последнее десятилетие особенное внимание в ряде новейших исследований уделяется клеточным и молекулярным маркерам, которые непосредственно характеризуют фундаментальные биологические свойства различных опухолей.
Так, на пороге второго тысячелетия в научной литературе стал общепризнанным термин «опухоли семейства саркомы Юинга» (ОССЮ), объединяющий как классическую костную форму саркомы Юинга, так и ее мягкотканную форму – периферическую примитивную нейроэктодермальную опухоль (ПНЭО) и злокачественную опухоль торакопульмональной зоны (опухоль Аскина) [1; 2]. Однако первое упоминание о заболевании было еще в 1921 году, когда J. Ewing впервые дал описание злокачественной опухоли костной ткани, состоящей из широких небольших, округлых синих клеток, позже получившей название «Саркома Юинга» (СЮ) [3].
В настоящее время полученные результаты исследований позволяют рассматривать СЮ, встречающуюся преимущественно у пациентов детского и подросткового возраста, характеризующуюся высокоагрессивным течением, а также наличием ряда тканеспецифических маркеров [4; 5], в качестве одной из высокозлокачественных мезенхимальных опухолей костей и мягких тканей [4]. Высокоагрессивный характер течения данной опухоли обуславливает наличие метастазов у 25-30% первичных больных на момент установления диагноза [3].
Научные открытия последних десятилетий внесли огромный вклад в понимание механизмов возникновения опухолевых клеток СЮ, однако в настоящее время все же остается ряд существенных малоизученных вопросов.
Общеизвестным является тот факт, что патоморфологические особенности ОССЮ, выявляемые при гистологическом исследовании, не всегда могут являться достаточными для точной постановки диагноза [5; 6], что в свою очередь диктует необходимость для поиска новых высокоспецифичных иммуногистохимических и цитогенетических маркеров, а также определения их прогностической значимости для данного семейства опухолей.
В литературе опубликовано большое число научных работ, направленных на изучение особенностей метаболизма костной ткани в норме и при различных видах опухолевых поражений костей, с целью определения новых молекулярно-генетических маркеров опухолевого роста. Однако наряду с этим механизмы, отвечающие за способность опухолевых клеток к инвазии в окружающие ткани, а также диссеминации с образованием вторичных- метастатических очагов опухолевого роста изучены мало. Кроме того, несмотря на большой прогресс в лечении различных форм СЮ, достигнутый в течение последних лет, показатели выживаемости по-прежнему остаются крайне низкими даже у пациентов с локализованными формами СЮ [7]. Возможно, при более детальном изучении данных ключевых вопросов появится возможность в высокоточной постановке диагноза и проведении своевременной персонифицированной этиотропной и патогенетической терапии, препятствующей возникновению, инвазии и диссеминации опухолевого процесса.
Цель исследования – обобщение результатов новейших молекулярно-генетических исследований в области изучения саркомы Юинга по данным мировой литературы.
Материалы и методы исследования. Выполнен критический анализ и обобщение результатов молекулярно-генетических исследований в области изучения саркомы Юинга за последние 10 лет по данным мировой литературы. Поиск публикаций осуществлялся по базам e-library, PubMed, RosOncoWeb, cyberleninka.
Результаты исследования и их обсуждение
Возникновение и развитие опухоли – сложный, многостадийный процесс, в основе которого лежат определенные изменения структурной и функциональной организации генетического аппарата клетки вследствие действия этиологических (канцерогенных) факторов, находящие свое отражение в изменении характера поведения клетки, ее пролиферативной активности и особенностях роста и развития.
Большое количество опухолей характеризуются наличием генных перестроек, играющих драйверную роль в процессах злокачественной трансформации. Наиболее типичным представителем такой группы опухолей является саркома Юинга, патогенез которой связан с транслокацией гена EWSR1 и семейства генов ETS. Изучение ОССЮ, в частности саркомы Юинга, посредством секвенирования показало, что присутствие диагностических перестроек в этой широкой группе опухолей примерно в 40% случаев является проявлением феномена хромоплексии – катастрофического геномного события, приводящего к одномоментным множественным разрывам хромосом по всему геному или во многих хромосомах, что ведет к появлению десятков различных транслокаций [8].
Некоторые авторы полагают, что саркомы Юинга, чей патогенез формируется по механизму хромоплексии, обладают большей иммуногенностью в сравнении с опухолями, для которых характерно появление изолированной транслокации EWSR1-ETS [9; 10]. Данная мысль может быть использована как в объяснении общих механизмов возникновения и развития СЮ, так и в ожидаемых результатах лечения – повышенная иммуногенность опухоли может являться основой реализации противоопухолевого иммунного ответа, изучение возможностей коррекции которого является одной из составляющей иммунотерапии новообразований.
В опухолевых клетках СЮ отмечается ряд подобных генетических изменений, что сопровождается появлением соответствующих онкопротеинов, вносящих вклад в злокачественные характеристики неоплазмы. Обнаружение данных генетических изменений и/или их результатов – онкобелков, позволяет осуществлять диагностику заболевания, разрабатывать стратегии лечения, оценивать его эффективность и строить прогнозы.
Учитывая данные новейших исследований в области диагностики СЮ, к наиболее специфичным маркерам данного заболевания относят EWS-FLI1 type 1, EWS-FLI type 2, EWS-ERG, NKX2-2, MIC2(СD99).
EWS-FLI1 type1 - химерный онкопротеин, являющийся высокоспецифичным и патогномоничным для клеток СЮ, возникающий в результате слияния экзона 7 гена EWS и фактора транскрипции семейства Ets, чаще всего 6 экзона гена FLI1, в результате хромосомной транслокации (t11;22) (q24; q12). Считается, что слияние генов EWS-FLI1 играет главную роль в саркомагенезе Юинга, и их транслокация составляет до 85% всех случаев заболевания СЮ. Причинный онкопротеин взаимодействует с промоторными участками соответствующих генов, изменяя их экспрессию, которые в свою очередь принимают непосредственное участие в неопластической трансформации опухолевых клеток, и необходим для пролиферации и других проявлений туморогенности клеток саркомы Юинга, в частности [11-13]. Однако наряду с этим имеется множество доказательств, говорящих о том, что один только EWS-FLI1 type 1-онкопротеин не может полностью объяснить патогенез развития саркомы Юинга. Было доказано, что EWS-FLI1 type1 коррелирует с более благоприятным прогнозом течения заболевания и встречается, как правило, у пациентов, имеющих локализованную форму СЮ [5; 11; 14].
EWS-FLI1 type 2 - это онкопротеин, образующийся при слиянии 7 экзона гена EWS и 5 экзона гена FLI1. Экспрессия данного типа белка встречается так же часто в клетках СЮ, как и экспрессия химерного онкобелка 1 типа, и коррелирует с менее благоприятным прогнозом течения саркомы Юинга. Некоторые авторы полагают, что данный онкопротеин участвует в регуляции транскрипции опухолевых клеток, а также в ингибировании апоптоза [5; 12; 15].
EWS-ERG - это химерный онкобелок атипичного характера, также встречающийся в опухолевых клетках СЮ, возникающий при транслокации t (21;22), в частности при слиянии 7 экзона гена EWS хромосомы 21 и 6 экзона гена ERG хромосомы 22 семейства Ets. Однако его экспрессия отмечается лишь в небольшом проценте случаев заболевания СЮ. EWS-ERG- -онкопротеину отводят главную роль в прогрессировании саркомы Юинга [11; 12; 14].
р30/32MIC2 (СD99) – продукт онкогена MIC-2, представляющий собой поверхностный гликопротеин, высокоспецифичная экспрессия которого в отношении опухоли СЮ достоверно доказана. CD99 экспрессируется практически в 100% клеток СЮ [16-18]. Определение его экспрессии в клетках опухоли является прямым подтверждением клинико-рентгенологического диагноза саркомы Юинга [17-19].
NKX2-2-ген - это член семейства гомеобоксных генов NK2 (Drosophila NK-homeobox genes.), который также является специфичным для клеток нейроэктодермальной природы и выявляется в различных клетках организма человека (клетки ЦНС, α- и β-клетки островков поджелудочной железы). В настоящее время имеются данные о том, что NKX2-2 является EWS/FLI-регулируемым геном и необходим для онкогенной трансформации клеток в этой опухоли [20-22]. Кроме того, существуют данные о том, что определение экспрессии гена NKX2-2 в диагностических целях позволяет с высокой точностью выявлять метастатическое поражение костного мозга при СЮ [20]. Данный маркер может быть использован для оценки поражения костного мозга у пациентов с различным генетическим профилем, в частности как у пациентов без выявленных перестроек генов EWS, FLI, так и с наличием атипичных перестроек генов (EWS, ERG) [21].
Однако стоит заметить, что ни NKX2-2, ни CD99 как отдельно взятые маркеры не являются специфичными [17; 18; 23], но при их сочетании диагностическая специфичность повышается [24].
Регуляция мезенхимально-эпителиального перехода и его роль в прометастатическом потенциале СЮ
Современные экспериментальные данные свидетельствуют о том, что для успешного метастазирования опухолевая клетка должна обладать как эпителиальными, так и мезенхимальными свойствами, что способствует росту опухолевых клеток, их инвазивной и миграционной способности.
Ученые придерживаются мнения о том, что в основе опухолевой прогрессии лежит такое явление, как «Эпителиально-мезенхимальный переход» (ЭМП, Epithelial-mesenchymal transition, EMT). Это явление было впервые описано Элизабет Хей (E.D. Hay) в 1995 году, исследовавшей его в курином эмбрионе и убедительно продемонстрировавшей ЭМП как особую морфологическую перестройку, которая определяет ряд ключевых стадий формирования и обособления эмбриональных тканей [25-27].
В соответствии с современными данными выделяют несколько типов эпителиально-мезенхимального перехода:
- 1 тип ЭМП реализуется в эмбриогенезе посредством участия в процессах гаструляции и миграции клеток, необходимых для формирования различных тканей, органов и структур организма;
- 2 тип ЭМП лежит в основе как репаративных посттравматических процессов при заживлении ран, так и в основе заболеваний, сопровождающихся фиброзом органов (чаще всего при фиброзе почек и легких);
- 3 тип ЭМП встречается при прогрессии эпителиальных опухолей и способствует приобретению опухолевыми клетками прометастатического потенциала и свойств опухолевых стволовых клеток.
Однако при саркоме Юинга представляется наиболее интересным процесс, обратный ЭМП - мезенхимально-эпителиальный переход (МЭП).
МЭП - это обратимый процесс, который участвует в миграции клеток и закладке тканей в период эмбриогенеза. В норме МЭП отвечает за механизм образования вторичного эпителия из мигрировавшей в нужное место мезенхимы. В настоящее время все чаще высказывается мнение, что ЭМП необходим опухолевым клеткам для обособления от первичной опухоли, инвазии в окружающие ткани и последующей диссеминации, в то время как возврат опухолевых клеток к эпителиальному фенотипу посредством МЭП необходим для начала роста метастазов [26; 28; 29]
Основными участниками различных стадий ЭМП и МЭП являются регуляторы как эпителиального, так и мезенхимального фенотипов (рисунок). К наиболее значимым относятся [27; 30]:
- белки, отвечающие за эпителиальный фенотип - Е-кадгерин, клаудины, окклюдины;
- белки, отвечающие за мезенхимальный фенотип - N-кадгерин, виментин, фибронектин;
- ферменты – матриксные металлопротеиназы;
- транскрипционные факторы - белки различных семейств: ZEB1, ZEB 2, Twist, Slug, Snail [31; 32].
По мере приобретения мезенхимальными клетками эпителиальных свойств, что имеет непосредственную связь с формированием метастатических очагов, отмечается увеличение экспрессии E-кадгерина, клаудинов, окклюдина и уменьшение экспрессии таких белков: N-кадгерина, виментина, фибронектина, ферментов - матриксных металлопротеиназ (MMP-2, MMP-9), белков - ZEB1, ZEB2, Twist, Slug, Snail [26; 33; 34].
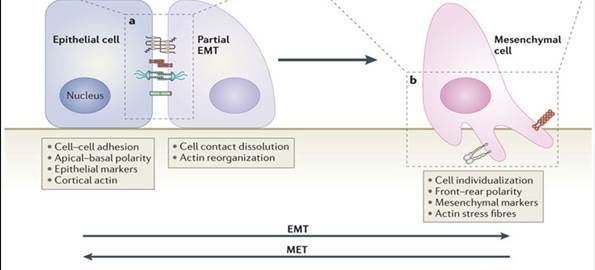
Взаимообратимые процессы эпителиально-мезенхимального и мезенхимально-эпителиального переходов
Матриксные металлопротеиназы (ММП) - это семейство внеклеточных, цинк- и кальцийсодержащих протеиназ. К настоящему времени известно 25 видов ММП. Металлопротеиназы являются активными участниками некоторых физиологических процессов ангиогенеза, морфогенеза, а также эмбриогенеза. Однако вместе с этим известно, что ММП непосредственно участвуют в процессах развития различных злокачественных опухолей, воздействуя на различные пути передачи сигнала в клетке, на межклеточные взаимодействия, посредством чего принимают участие в инвазивном росте и метастазировании опухолей [35]. Непосредственно в опухолевых тканях СЮ достоверно выявлен повышенный уровень экспрессии ММП-2, -9 и повышенный уровень их тканевого ингибитора (ТИМП-1), что способствует лизису базальной мембраны и высвобождению опухолевых клеток, что является одним из факторов, способствующим раннему метастазированию СЮ [34; 35].
Ученые придерживаются мнения о том, что метастазы СЮ состоят в основном из двух типов клеток: преимущественно эпителиальных, связанных между собой межклеточными спайками в организованную структуру, и мезенхимальных клеток, не имеющих клеточных контактов и способных мигрировать как отдельные клетки. В то время как первичная опухоль имеет 3 типа клеток: преимущественно опухолевые клетки с мезенхимальным фенотипом, клетки опухоли, имеющие пограничное состояние и обладающие некоторыми свойствами стволовых клеток, а также клетки с эпителиальным фенотипом [26; 30; 34].
Клетки СЮ проявляют как мезенхимальные, так и эпителиальные особенности. Имеются данные о том, что белки ZEB1, ZEB2, Twist, Slug, Snail, являющиеся транскрипционными факторами генов, кодирующих белки плотных контактов, непосредственно осуществляют прямую регуляцию Е-кадгерина, за счет чего могут изменять фенотип опухолевой клетки. Эти процессы в свою очередь определяют переход мезенхимального фенотипа в эпителиальный в клетках СЮ, что повышает метастатический потенциал опухоли в целом [36].
Эпителиальный кадгерин (CDH1 или E-кадгерин) - это трансмембранный гликопротеин, относящийся к семейству классических кадгеринов, который экспрессируется в различных тканях и играет роль в Ca2+-зависимой межклеточной адгезии. Е-кадгерин обеспечивает плотный межклеточный контакт на базальных и боковых поверхностях клеток и является отличительным признаком эпителиальных клеток [26; 31]. Следует отметить, что, по данным различных авторов, при саркомагенезе происходит как подавление экспрессии Е-кадгерина, участвующего в образовании плотных контактов между эпителиоцитами, так и его активация. Регуляция данного пускового процесса обусловливает инвазию и миграцию клеток СЮ с формированием метастатических очагов [31; 37].
Так называемая межклеточная адгезия – это обязательное условие для сохранения упорядоченной структуры ткани и поддержания взаимосвязи между клетками. Е-кадгерин играет непосредственную роль в ЭМП и МЭП, которые становятся неконтролируемыми при злокачественных новообразованиях. Кроме этого, он может выступать в качестве супрессора при опухолевом росте и опухолевой прогрессии, что имеет большое значение в течении опухолевого процесса СЮ [26; 31; 34].
Клаудины представляют собой наиболее крупное семейство белков, которые являются важными компонентами тесных межклеточных контактов, где они формируют параклеточный барьер. В организме человека семейство клаудинов представлено 24 белками, и существуют данные о том, что некоторые из них являются высокоспецифичными для различных тканей и органов человека. Их структура представлена четырьмя трансмембранными доменами, двумя внеклеточными и одной внутриклеточной петлями, а также N-концевой и С-концевой частями, расположенными в цитоплазме. Все это позволяет им воспроизводить так называемые гексамерные связи, посредством чего участвовать не только в организации клеточных связей, но и в транспорте ионов и молекул в клетку. Профиль экспрессии клаудинов, их типы и распределение в мембранах клеток различных тканей имеет свои особенности, определяющие характер взаимодействий клеток друг с другом и с факторами межклеточного вещества, это в свою очередь может выступать специфической характеристикой параметров метастатической ниши в определенных тканях и органах [38].
Окклюдины являются одними из представителей групп белков плотных контактов и занимают второе место по распространенности в плотных контактах после семейства клаудинов. Строение и основные функции семейства окклюдинов практически совпадают с таковыми у семейства клаудинов. Кроме того, они регулируют транспорт некоторых гидрофильных молекул с небольшой молекулярной массой, регулируют прохождение нейтрофилов через эпителий и наряду с этим являются непосредственным участником ЭПМ и МЭП [31; 39; 40].
Виментин и фибронектин - компоненты цитоскелета и внеклеточного матрикса [19; 26; 41] - это белки, отвечающие за мезенхимальный фенотип эпителиоцитов и играющие одну из ключевых ролей в МЭП. Экспрессируются практически во всех клетках СЮ, способствуя миграции и метастазированию опухолевых клеток [26; 31; 34].
Кроме вышеуказанных маркеров, обращает на себя внимание наличие в ткани СЮ целого ряда молекул, характерных для особой субпопуляции опухолевых клеток (ОСК), играющих важную роль в поддержании опухоли, процессах ее метастазирования, химио- и радиорезистентности.
SOX2 и СНМ1 как регуляторы пролиферации опухолевых клеток
SOX2 – транскрипционный фактор самообновления и поддержания недифференцированных эмбриональных стволовых клеток (ЭСК). Экспрессия SOX2 возникает при многих злокачественных опухолях, и его роль как онкопротеина была неоднократно подтверждена в ходе многочисленных исследований. В частности, при СЮ SOX2 активно участвует в пролиферации опухолевых клеток, являясь мишенью для EWS-FLI1, посредством чего осуществляется регуляция дифференцировки опухолевой клетки в фазах клеточного цикла и регулируется апоптоз. Таким образом, SOX2 увеличивает период жизни опухолевых клеток СЮ путем стимулирования прогрессии клеточного цикла и ограничения апоптоза [42].
CHM1 (хондромодулин 1, CNMD) – эндохондральный белок, в нормальных условиях экспрессирующийся в хряще и влияющий на развитие и пролиферацию хондроцитов. Однако сверэкспрессия CHM1 отмечалась в образцах метастазов в легочную ткань пациентов с СЮ по сравнению с образцами, полученными из разных локализаций костей. Это указывает на то, что CHM1 участвует в инвазии и метастазировании опухолевых клеток в легкие и имеет важное значение для диссеминации опухолевого процесса [43].
Выводы
Изучение молекулярно-генетических особенностей патогенеза локальных и метастатических форм СЮ остаётся перспективным направлением для медико-биологических исследований и должно быть направлено на понимание механизмов инвазии и диссеминации опухолевых клеток, что в свою очередь поможет в создании высокоэффективной терапии, препятствующей развитию и метастазированию опухолевого процесса.



