Вне зависимости от того, что заболеваемость раком желудка в России не находится на высоком уровне, в структуре смертности от злокачественных новообразований он занимает 2 место. Это свидетельствует о поздней диагностике рака желудка и агрессивном течении заболевания [1]. Процессы прогрессирования заболевания, вероятность метастазирования и развитие устойчивости к применяемой терапии определяются особенностями экспрессии определенных генов, изменением фенотипа опухолевых клеток, что сопровождается закономерными метаболическими, морфологическими и иммунологическими их изменениями [2; 3]. Кроме того, указанные свойства опухолей определяются наличием особой субпопуляции клеток – опухолевыми, раковыми стволовыми клетками (ОСК, РСК). Показано, что маркеры, выявленные на раковых стволовых клетках, представлены и на определенных типах соматических клеток организма человека, на эмбриональных и мезенхимальных стволовых клетках [4]. Несмотря на то что данные клетки достаточно трудно идентифицировать, число работ, посвященных изучению биологических и клинических особенностей ОСК при различных формах онкологических заболеваний, неуклонно растет [5].
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессии опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [6].
Одним из маркеров раковых стволовых клеток является CD44 - это адгезивный белок, который участвует во взаимодействиях клетка–клетка и клетка–межклеточный матрикс посредством своего лиганда – гиалуроновой кислоты, а также коллагена, ламинина, фибронектина, остеопонтина и некоторых гликозаминогликанов. У CD44+ опухолевых клеток описана более высокая туморогенность (пролиферативный потенциал, способность к формированию колоний), резистентность к лекарственному воздействию, меньшая склонность к апоптозу по сравнению с CD44- клетками [7].
CD44 изолированно или в комбинации с другими маркерами выявляется на ОСК в раке молочной, предстательной и поджелудочной желез, печени, колоректальном раке, опухолях головы и шеи, желудка [8].
CD133 (АС133, проминин-1) впервые был обнаружен Х. Yin и соавт. в 1997 г. на гемопоэтических стволовых клетках [9]. Это гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [10], принадлежит к семейству промининов, имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Ген (PROM1) картирован на 4р15.32. Ассоциирован с мембранными выпячиваниями, но функция его точно не известна. Было также показано, что экспрессия антигена CD133 коррелирует с выживаемостью пациентов с аденокарциномой желудка [11]. Кроме того, у пациентов с колоректальной карциномой комбинация CD133, CD44 и CD166 может успешно идентифицировать пациентов при рецидиве и метастазировании с низким, средним и высоким риском [12].
Для идентификации ОСК при раке желудка чаще всего используют фенотипический маркёр CD44+, наличие которого с высокой вероятностью может указывать на данный тип клеток. Использование же CD133 при обнаружении РСК при раке желудка отмечается не так часто, и его информативность при данной форме опухолей обсуждается.
Таким образом, к настоящему времени накоплен определенный опыт исследования ОСК при различных солидных опухолях, однако вопросы, связанные с особенностями фенотипической организации и «поведении» данной популяции клеток при ряде заболеваний, в частности при различных формах рака желудка, остаются изучены не полностью.
Цель работы: исследование CD44+, CD133+ - ОСК в различных тканях при не метастатической и метастатической форме рака желудка с использованием метода проточной цитофлюориметрии.
Материалы и методы
В исследование включено 18 больных раком желудка в возрасте от 30 до 80 лет. Больные давали письменное информированное согласие на проведение исследований, подвергались стандартному в данном случае объему обследований. Пациенты были разделены на две группы:
1 группа – М0, рак желудка без метастазов, 11 человек, степень дифференцировки опухоли – G2, средний возраст 58,9±9,7.
2 группа – М1, рак желудка с выявленными метастазами в брюшину и большой сальник, 7 человек, степень дифференцировки опухоли– G2, средний возраст 53,4±11,9.
Непосредственно после оперативного вмешательства осуществляли забор следующих образцов: опухоль (ОП), перифокальная зона (ПЗ), сальник (СА), брюшина (БР), которые ex temporae помещались в раствор CellWash и подвергались дезинтеграции с использованием BD Medimachine в течение 30–60 сек. Полученную клеточную взвесь после фильтрования центрифугировали в течение 4 мин. при 1500 об/мин. в центрифуге Еppendorf 5702 R. Осажденные клетки ресуспендировали раствором CellWash.
Фенотипирование клеток осуществляли на проточном цитометре FACSCantoII (BD, USA) после их обработки панелью антител (CD45, CD44, CD133). Аналитические процедуры осуществляли в соответствии с указаниями фирмы - производителя наборов. Результаты определения клеток, имеющих маркеры ОСК (CD44+, CD133+), выражали в процентах от общего количества лимфоцитов CD45+-клеток либо от общего числа CD45--клеток.
Статистическая обработка полученных результатов предполагала расчет средних значений и стандартных отклонений. После проверки характера распределения проводили оценку статистической значимости различий между группами. В случае нормального распределения использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна-Уитни. Различия считали статистически значимыми при р≤0,05.
Результаты исследования
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка без метастатических поражений (М0), представленные на рисунке 1.
В группе М0 при степени дифференцировки опухоли G2 процентное содержание клеток с фенотипом CD45+CD44+ в ткани опухоли и брюшины статистически не отличалось и составило 3,4±1,4 и 3,8±1,6 соответственно. При этом отмечено увеличение клеток с данным фенотипом в сальнике - 8,4±4,5, что больше количества этих клеток в ткани опухоли на 147% (в 2,4 раза), р=0,002. В случае ПЗ не удалось определить клетки с данным фенотипом.
Определение клеток с фенотипом CD45-CD44+ позволило выявить следующие закономерности. Наибольшее количество клеток данного фенотипа выявлено в ткани БР – 1,1±0,5, что выше значений данного показателя в ОП (0,65±0,3) и СА (0,3±0,1) на 69% (в 1,7 раза) и 267% (3,7 раза) соответственно, р=0,001.
Другим маркёром опухолевых стволовых клеток является CD133+. Определение клеток, имеющих фенотип CD45+CD133+, выявило большее процентное число данных клеток в ткани ОП – 2,75±0,9. В БР и СА количество данных клеток было ниже значений в ОП соответственно на 60% (2,5 раза) – 1,1±0,4, и 93% (13,8 раз) – 0,2±0,05, р=0,02. В ПЗ клетки с данным фенотипом не определялись (рис. 1).
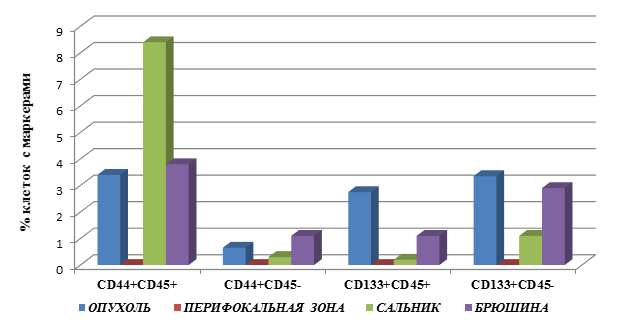
Рис. 1. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 1 (М0) – без метастатических поражений
Следует отметить, что определение процентного содержания клеток с фенотипом CD45-CD133+ имело аналогичные закономерности распределения, однако число данных клеток во всех тканях было выше, чем клеток с фенотипом CD45+CD133+. Максимальное число данных клеток выявлено в ОП – 3,35±2,7, затем в БР – 2,9±1,1 и в СА – 1,1±0,4. Полученные результаты меньше значений в ОП соответственно на 13% (в 1,2 раза) для БР и на 67% (в 3 раза) для СА, р=0,02. В ПЗ клеток с данным фенотипом не выявлено.
Таким образом, при раке желудка у пациентов без выявленных метастатических поражений в опухоли наблюдается накопление клеток с фенотипом CD45+CD133+ и CD45-CD133+, превышающее таковое в брюшине и сальнике. Кроме того, процентное содержание клеток с фенотипом CD45+CD44+ было выше в сальнике, а с фенотипом - CD45-CD44+ - в опухоли (рис. 1).
Выявлены следующие особенности процентного содержания клеток с маркёрами опухолевых стволовых клеток в группе пациентов с раком желудка, стадия дифференцировки опухоли G2 с метастатическими поражениями (М1), которые представлены на рисунке 2.
Наибольшее процентное содержание клеток с фенотипом CD45+CD44+ у больных раком желудка с метастатическими поражениями выявлено в ткани ОП – 19,8±4,5, в то время как в БР – 9,7±1,5, с практически одинаковым количеством данных клеток в ПЗ, СА – соответственно 4,4±1,5 и 4,2±1,2. Полученные значения ниже данного показателя в ОП на 79% (в 4,7 раза), 78% (4,5 раза) и 51% (в 2 раза) для СА, ПЗ и БР соответственно (для всех результатов р=0,03).
Обращает внимание тот факт, что у больных с метастатическими поражениями при РЖ по сравнению с данным показателем у пациентов без метастазов количество клеток с фенотипом CD45+CD44+ в ОП было выше на 482% (в 5,8 раза), в БР – на 155% (в 2,6 раза), а в СА – ниже на 50% (в 2 раза), р=0,03. Кроме того, данный тип клеток появляется в ПЗ пациентов группы М1, в то время как у больных М0 они не определялись (рис. 2).
Наибольшее количество клеток с фенотипом CD45-CD44+ у больных с метастазами отмечается в СА и ПЗ, соответственно 3,3±1,4 и 0,9±0,05, что превышает в 11 раз показатель у пациентов без метастазов (для СА). В ОП и БР данный тип клеток не выявлен при наличии метастазов, в то время как без них они определялись.
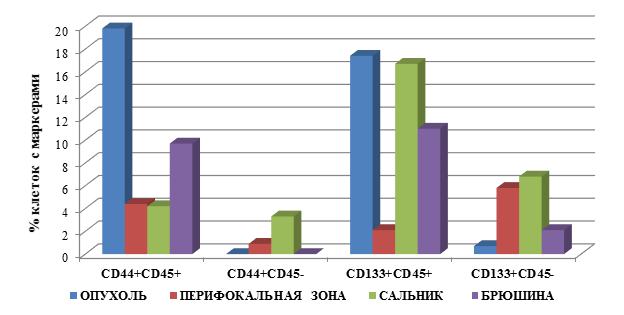
Рис. 2. Процентное содержание клеток с маркерами ОСК в тканях больных раком желудка, группа 2 (М1) – с метастатическими поражениями
При определении другого, менее часто используемого для идентификации ОСК РЖ маркера CD133, выявлены следующие особенности при наличии метастатических поражений.
Количество клеток с фенотипом CD45+CD133+ было максимальным в ОП и СА, соответственно 17,4±2,5 и 16,7±2,1, что выше значений у пациентов группы М0 в 6,3 и в 84 раза, т.е. максимальный прирост данных клеток выявлен в СА. В ПЗ у больных М1 группы количество было ниже на 37% (в 1,6 раза) по сравнению с значениями в ОП, но превышало значения данного показателя у пациентов без метастатических поражений в 10 раз. Следует отметить, что на фоне метастатических поражений данные клетки обнаруживаются и в ПЗ, чего не наблюдалось у больных РЖ без метастазов. Однако значение данного показателя было ниже на 88% (в 8,3 раза) количества данных клеток в ОП.
У больных группы М1 клетки фенотипом CD45-CD133+ в максимальном количестве определялись в СА, ПЗ и БР, соответственно 6,8±1,5, 5,8±1,8 и 2,1±0,3, в то время как в ОП их число было относительно невелико – 0,7±0,05. При этом, как правило, количество данных клеток существенно превышало данный показатель у больных без метастатических поражений в случае СА – в 6 раз (выше на 518%), в ПЗ эти клетки обнаруживались у пациентов с поражениями, в то время как без метастазов они не выявлялись. Однако количество клеток с фенотипом CD45-CD133+ снижалось у пациентов с метастазами в ОП и БР – отмечено снижение данного показателя на 79% (4,8 раза) и 28% (1,4 раза) соответственно, р=0,02.
Таким образом, у больных РЖ с метастатическими поражениями по сравнению с пациентами без метастазов (рис. 2):
- в ОП – увеличивается количество клеток фенотипа CD45+CD44+ и CD45+CD133+ и уменьшается число клеток CD45-CD44+ и CD45-CD133+;
- в ПЗ – отмечается рост числа клеток всех определяемых фенотипов CD45+CD44+ и CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в СА – снижается число клеток с фенотипом CD45+CD44+ и увеличивается число клеток остальных типов: CD45+CD133+, CD45-CD44+ и CD45-CD133+;
- в БР – увеличивается число клеток с фенотипом CD45+CD44+ и CD45+CD133+, а количество клеток CD45-CD44+ и CD45-CD133+, напротив, снижается.
Заключение
Проведенное исследование позволило выявить некоторые особенности распределения клеток, имеющих маркёры ОСК в различных тканях у больных раком желудка, что может в дальнейшем быть использовано при оценке особенностей развития и прогрессирования заболевания, эффективности проводимой терапии. Полученные результаты являются основой для дальнейшего научного поиска в отношении наиболее полной характеристики гетерогенной опухолевой популяции при раке желудка, роли отдельных клеток в росте, прогрессии и метастазировании опухоли.



