Обширные гнойно-некротические раны являются одной из актуальных и нерешенных проблем в гнойной хирургии. Определенные успехи в лечении данного контингента больных достигнуты во многом благодаря этиопатогенетическому подходу, подразумевающему активную хирургическую тактику в отношении очага инфекции, что создает объективные предпосылки для ликвидации гнойно-некротического процесса и заживления раны. Однако вместе с этим адекватная хирургическая обработка нередко приводит к образованию обширных постнекрэктомических ран, самостоятельное заживление которых невозможно из-за их значительных размеров. При этом больные подвергаются многократным санационным и кожно-пластическим вмешательствам, что определяет длительные сроки нетрудоспособности больных, в конечном счете косметические и функциональные результаты лечения нередко оказываются неудовлетворительными. Частая смена повязок, постоянная травматизация раны во время перевязок, распространение процесса на здоровые ткани, неприятный запах, интоксикация, высокая вероятность развития раневого сепсиса являются основанием для разработки новых методов лечения гнойно-некротических ран. Следует подчеркнуть, что образовавшийся обширный дефект кожи значительно удлиняет сроки лечения и является входными воротами для нозокомиальной инфекции. Для профилактики возможных осложнений бесспорным является применение высокоэффективных методов лечения гнойных ран с целью создания условий для более ранней аутодермопластики. Одним из эффективных методов лечения у данной категории больных является применение локальной вакуум-аспирации. В литературе встречаются различные термины, обозначающие вакуум-терапию. Часто применяются такие названия метода, как: «лечение ран отрицательным давлением» или «Negative pressure wound treatment» (NPWT), «VAC-therapy», «Topical negative pressure treatment» (TNP). В отечественной литературе наиболее часто используются определения: «вакуум-терапия ран», «вакуум-ассистированные повязки», «лечение ран отрицательным давлением» [1-3]. Исследования показали, что вакуум-терапия оказывает положительное влияние на течение всех стадий раневого процесса. Это проявляется уменьшением местного отека, снижением продукции раневого отделяемого, улучшением микроциркуляции, также оказывает пагубное влияние на микробную флору, снижая местную обсемененность. Рана остается влажной, что благоприятно сказывается на ее заживлении. Данные эффекты ускоряют клеточную пролиферацию, синтез в ране протеинов и основного вещества соединительной ткани усиливается, что в результате приводит к ускоренному заживлению раны [4-6]. Создание отрицательного давления способствует увеличению в зоне воспаления числа макрофагов, участвующих в очищении раны от мертвых клеток, девитализированных тканей и токсинов микроорганизмов. В свою очередь фагоцитарная активность приводит к увеличению в тканях кислой фосфомоноэстеразы, в крови повышается уровень нормальных антител. Местное отрицательное давление приводит к эволюции репаративных явлений и, как исход, подготовленности поверхности кожного дефекта к пластическому закрытию [7-9]. Уровень отрицательного давления может быть в пределах от 50 до 200 мм рт. ст. Считается, что оптимальный уровень отрицательного давления в ране –125 мм рт. ст. По литературным данным и по собственному опыту лечения известно, что дефекты кожи более 5 см в диаметре самостоятельно не эпителизируются. Такие раны и раны большего диаметра необходимо закрывать применением аутодермопластики. В силу доступности, дешевизны и высокой эффективности на сегодняшний день аутодермопластика расщепленным кожным лоскутом является часто применяемым, конечным этапом лечения обширных дефектов кожи, но имеет некоторые недостатки. Нередко после дермопластики первая же перевязка может стать причиной отхождения трансплантата. При этом причина будет механической, трансплантат отлипает с реципиентской поверхности вместе с перевязочным материалом [10]. Одна из частых причин – это слабое прижатие трансплантата к раневой поверхности. Для предупреждения данных негативных последствий обычно первую перевязку рекомендуют проводить на четвертые-пятые сутки после аутодермопластики, так как редкая перевязка способствует сохранности трансплантата на раневой поверхности.
Цель: улучшить результаты лечения больных с обширными гнойно-некротическими ранами, вызванными рожистым воспалением.
Задачи исследования: дать клиническую оценку эффективности вакуум-ассистированной кожной пластики в комплексном лечении больных с некротической формой рожи.
Материал и методы. Мы имеем опыт лечения 144 больных в возрасте 59,3±7,4 года с различными гнойно-некротическими ранами, находившихся на лечении в отделении гнойной хирургии ГКБ № 8 г. Уфы с 2014 по 2017 гг. Из них 76 (52,8%) лица мужского пола и 68 (47,2%) женщин. У 67 больных гнойно-некротические осложнения развились на фоне сахарного диабета, у 27 больных – на фоне хронической венозной недостаточности, у 11 больных были обусловлены отморожениями нижних и верхних конечностей. В данной работе приводим данные о результатах лечения 39 больных с гнойно-некротическими осложнениями рожистого воспаления с применением вакуум-терапии в сочетании с аутодермопластикой. Размеры дефекта варьировали от 12 до 284 см2. Кроме того, больные получали комплексное лечение, заключающееся в применении антибиотиков, им проводили коррекцию нарушенного белкового, углеводного и электролитного баланса, кислотно-щелочного состояния. В обеих группах проводилось лечение, направленное на улучшение кровообращения: назначались дезагреганты, ангиопротекторы, больным с сахарным диабетом проводили коррекцию уровня глюкозы крови. Эффективность вакуум-терапии оценивали, основываясь на динамике клинических проявлений, определении степени микробной контаминации в ране, анализе клеточного состава раневых отпечатков, фагоцитарного числа, фагоцитарной активности нейтрофилов, определении индекса завершенности фагоцитоза. Исследования проводили по общепринятым методикам. Статистическую обработку результатов исследования проводили путем определения среднего арифметического значения (М) и его ошибки (m). Достоверность разницы средних величин определяли с помощью критерия Стьюдента. В качестве источника отрицательного давления использовали аппарат S042 NPWT VivanoTec (Германия).
Все пациенты были разделены на две группы: основная группа (20 пациентов), контрольная группа (19 пациентов). В основную группу включены больные, у которых для фиксации кожного трансплантата использовалась вакуум-повязка. У больных контрольной группы после пересадки кожного лоскута фиксацию трансплантата осуществляли повязкой с антисептиками. Больные обеих групп подвергались практически схожему по технике и объему хирургическому вмешательству. В обеих группах размеры раневого дефекта, степень нарушения артериального притока в нижних конечностях, бактериальной обсемененности зоны повреждения, количество гемоглобина и эритроцитов крови, сопутствующая патология варьировали незначительно. Эффективность лечения оценивалась определением местного и общего проявления раневого процесса. Определяли температурную реакцию больного, динамику боли, гиперемию кожи, местный отек и инфильтрацию тканей в зоне существующей раны, длительность фаз раневого процесса, степень и сроки эпителизации раны и формирования рубца. Определяли качественный и количественный состав раневой инфекции, выполняли гистологическое исследование биоптатов из ран, проводили регистрацию скорости уменьшения раневой поверхности и уменьшение перифокального воспаления по собственной методике. Проводили цитологическое исследование по методу отпечатков, разработанному М.П. Покровской, М.С. Макаровым (1942). Данными методами получали объективную картину морфологических изменений, происходящих в ране. В препаратах-опечатках исследовалось процентное соотношение форменных элементов. Все исследования выполнялись в сроки от первичного оперативного вмешательства до закрытия раны. У пациентов обеих групп производился забор раневого отделяемого: первый раз, на 3–5-е сутки от начала лечения, и на 8–11-е сутки. Микробиологический фон был представлен в основном E. coli, Staphylococcus epidermidis и Staphylococcus aureus. Сравниваемые показатели в обеих группах больных с некротической рожей были сопоставимы и статистически не отличались друг от друга (р<0,05).
Результаты и обсуждение. Больным обеих групп при поступлении проводились хирургическая обработка раны с иссечением некротических тканей, непродолжительное классическое лечение в течение 4–6 суток, лечение продолжили с применением вакуум-терапии 4–5 суток в режиме постоянной аспирации (–125 мм рт. ст.) (рис. 1).

Рис. 1. Вакуум-терапия на этапе лечения гнойной раны
Очищение раны у пациентов при подготовке раны к пересадке в контрольной и основной группах наступало спустя 5,1±0,5 суток от начала лечения, появление грануляционной ткани – спустя 8,1±0,6 суток, охват грануляционной тканью всей поверхности раны – спустя 11,0±0,4 суток.
Больным при поступлении в клинику проводилось хирургическое лечение, заключающееся во вскрытии гнойного очага, некрэктомии. Послеоперационный период протекал обычно. Из раны наблюдалось гнойное отделяемое, имели место покраснение кожи вокруг раны, отек, местное повышение температуры, фибринозно-гнойный налет и болезненность при пальпации краев раны. Первые 3 суток у больных превалировали жалобы на боли в области раны, усиливающиеся при физической активности, присутствовало чувство слабости, отмечались субфебрилитет и нередко фебрильная температура тела. При определении степени микробной контаминации с 3,6±1,2х108 до 4,2±0,9х106 /г, оставаясь выше критического числа. После установки вакуум-аспиратора общее состояние и общее самочувствие больных заметно улучшалось, уже к 5-му дню отмечались очищение раны и появление грануляции. Параллельно с очищением раневой поверхности от некрозов и заполнением их грануляционной тканью исчезали местные региональные признаки воспаления. Степень микробной обсемененности составила от 1,9±0,7х104 до 2,6±0,5х104 / г ткани (табл. 1).
Таблица 1
Степень микробной контаминации гнойных ран в разные сроки лечения
|
Сроки лечения, суток |
Количество микроорганизмов КОЕ/г |
Критерий достоверности |
|
|
Основная группа п=20 |
Контрольная группа п=19 |
||
|
1-е |
3,6±1,2х108 |
2,8±1,1х108 |
р< 0,05 |
|
3-е |
4,2±0,9х106 |
3,4±0,9х106 |
р< 0,05 |
|
5-е |
2,6±0,5х104 |
1,9±0,7х104 |
р< 0,05 |
|
7-е |
1,8±0,2х102 |
2,1±0,9х102 |
р< 0,05 |
Следует отметить, что больные обеих групп нуждались для закрытия дефектов кожи в проведении аутодермопластики (рис. 2).
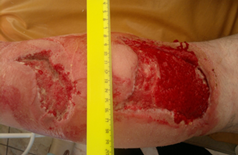
Рис.2. Внешний вид раны после вакуум-терапии
Пересадка кожи выполнялась во второй фазе раневого процесса при бактериальной обсемененности раны менее 102 КОЕ на 1 г ткани и при получении регенераторного типа цитограмм раневого экссудата.
У больных основной группы после пересадки расщепленного кожного лоскута поверх трансплантата установили поролоновую повязку и продолжали вакуум-терапию в течение 4–5 суток с созданием отрицательного давления в прерывистом режиме, который заключался в создании отрицательного давления до –125 мм рт. ст. в течение 10 мин, а далее 3 мин – отсутствие вакуума. При вакуумировании губчатая повязка уменьшалась в размере, сжималась и придавливала пересаженный кожный лоскут к раневой поверхности. Это способствовало стабилизации лоскута в ране без иммобилизации конечности и нивелировало вероятность его смещения в ближайшие дни после пластики. Вакуум-терапию отменяли спустя 4–5 дней. За это время происходила достаточно удовлетворительная фиксация пересаженных кожных лоскутов к поверхности (рис. 3).
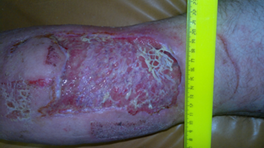
Рис. 3. Приживление кожного лоскута в ране при сочетании с вакуум-терапией
Использование вакуум-аппарата способствовало дозированному прижатию кожного лоскута к раневой поверхности, надежной фиксации кожного лоскута и в определенной степени – улучшению местной микроциркуляции. Проведенная аутодермопластика была эффективной во всех случаях. Ранние послеоперационные осложнения в виде лизиса, отторжения пересаженного кожного лоскута наблюдали у 1 больного основной и 2 больных контрольной группы, причиной чему было критическое нарушение магистрального кровообращения. Примечательно то, что даже при наличии выраженной ишемии тканей в области пересаженной кожи у больного основной группы удалось ее приживить. Но после снятия вакуума произошли лизис трансплантата и его отторжение.
При использовании в послеоперационном периоде вакуума в основной группе приживление кожного лоскута составляло 82% поверхности раны, а у больных контрольной группы, без вакуум-терапии в послеоперационном периоде приживление составило 75% поверхности. Для определения площади ран и площади перифокального воспаления чаще используют планиметрический метод Л.Н. Поповой [4, 8, 10], который является довольно трудоемким, неизбежно сопровождается контактом раневой поверхности. Нами разработан инновационный способ определения площади раневого дефекта с использованием компьютерной программы GIMP-2 и цифровой фотокамеры любительского уровня (заявка на изобретение № 2013130184/14 Технологический способ определения площади поражения кожи). С этой целью вначале на цифровую фотокамеру производятся снимки участка поврежденной кожи. Далее информация загружается в память компьютера. Необходимо заранее загрузить программу GIMP-2. Программа GNU Image Manipulation Program на деле предназначена для создания и обработки растровой графики и частично поддерживает работы с векторной графикой.
Во время перевязки больного производится фотографирование поврежденного участка кожи. Предварительно рядом с кожным дефектом размещается сантиметровая лента или лента со шкалой. Далее фотография загружается в память компьютера для обработки при помощи программы GIMP-2, для чего фотография загружается в программу (файл-открыть-поиск), в гистограмме (окна-гистограммы) в интерфейсе, далее в инструментах выбирается «Выделение области произвольными линиями или отрезками f». Далее выделяется участок поврежденной ткани в загруженной фотографии. В итоге получаем в значениях гистограммы цифровое обозначение площади данной области в пикселях (рис. 4).
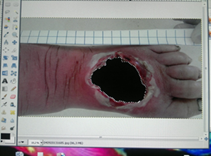
Рис. 4. Этап обработки фотографии. При помощи программы выделена зона некроза с целью определения пикселей
Далее переводят полученные цифры в квадратные сантиметры, определяя, сколько пикселей вмещается в 1 см, сравнивая значение 1 см на сантиметровой ленте в 1 см на фотографии. Это происходит следующим образом: выбираем в панели инструментов «измеритель расстояний», значения точек (пикселей) показываются в нижней части экрана. Находится значение пикселей для 1 см, полученное значение возводится в квадрат для получения значения в 1 см2. В конце вычислений общее количество пикселей зоны повреждения переводится в квадратные сантиметры. Для определения площади перифокального воспаления (зоны гиперемии) вначале определяется общая площадь воспаления тем же способом, что описано выше, и из значения общей площади вычитается площадь поврежденного участка кожи. Применение в лечебной практике представленного метода повышает точность измерения площади повреждения кожи. Каждодневное измерение площади покраснения вокруг раны позволяет объективно оценивать эффективность лечения больных и дает возможность своевременно изменить тактику лечения.
Выводы
Применение вакуум-терапии в течение 4–5 суток в режиме постоянной аспирации (–125 мм рт. ст.) способствует очищению гнойной раны, сокращает первую фазу раневого процесса и потенцирует заполнение раневой поверхности зрелой грануляционной тканью (р<0,005).
Использование вакуумной терапии после кожной пластики выполняет функцию вакуумной повязки, тем самым обеспечивает надежную фиксацию кожных трансплантатов на поверхности раны, исключает риск их смещения в ближайшее время после аутодермопластики.
Изолированный вакуум при кожной пластике желательно применять в клинической практике у больных с гнойно-некротическими ранами и при некротической форме рожистого воспаления для заживления обширных кожных дефектов.



