Эндопротезы с металл-металлическими парами трения в настоящее время требуют тщательного наблюдения в связи с высокой частотой развития осложнений, в результате которых выполняется ревизионное эндопротезирование [1].
Пара трения металл-металл стала широко применяться в эндопротезировании тазобедренного сустава с 2000-х годов в связи с ее теоретическими преимуществами – минимальным износом, а также возможностью использовать головки большого диаметра, что позволяет снизить вероятность вывихов и добиться большого объема движений в суставе [2]. Их использование возросло с 7% от общего числа эндопротезов тазобедренного сустава в 2001 году до 31% в 2011 году [3]. Однако в дальнейшем исследования показали, что металлический дебрис, образующийся в результате трения между металлической головкой и вкладышем, а точнее ионы кобальта и хрома могут вызывать как локальные, так и системные осложнения [4]. Ионы металлов захватываются преимущественно лимфоцитами, которые активируют иммунный ответ, в результате чего развивается острая локальная реакция мягких тканей на металлический дебрис, которая включает в себя образование псевдоопухолей, развитие некроза мягких тканей и остеолиз [5; 6]. Также считается, что ионы кобальта и хрома, попадая в кровь, спинномозговую жидкость и мочу, могут вызывать различные системные осложнения, такие как периферическая нейропатия, потеря слуха, поражение щитовидной железы и кардиомиопатия [5; 7]. Поэтому в дальнейшем массовое использование данных протезов было прекращено и разработан ряд рекомендаций по ведению пациентов.
Однако до настоящего времени все еще не определены пороговые значения концентрации ионов этих металлов в сыворотке крови и моче, позволяющие прогнозировать развитие системных осложнений, мало изучена взаимосвязь уровня ионов металлов с появлением и прогрессированием локальных осложнений.
Таким образом, важным вопросом остается ведение пациентов, у которых установлены эндопротезы тазобедренного сустава с парой трения металл-металл [8]. По этому вопросу в разных странах существуют собственные рекомендации. Например, MHRA (Medicines & Healthcare products Regulatory Agency) в Великобритании неоднократно дорабатывала рекомендации по ведению пациентов с эндопротезами с металл-металлическими парами трениями. Первичные рекомендации, выпущенные в 2012 году, были скорректированы в 2013, затем в 2015 годах. Последние рекомендации опубликованы в 2017 году [9]. В них рекомендуется всем пациентам выполнять анализ крови для определения концентрации ионов кобальта и хрома в крови пациентов, обзорные рентгенограммы таза, МРТ с режимом металлоподавления и/или ультразвуковое исследование тазобедренного сустава, а также опросник Oxford для клинико-функциональной оценки. Кратность данных исследований определяется полом пациента, наличием жалоб со стороны эндопротеза, типом эндопротеза (наличием или отсутствием бедренного компонента), а также диаметром головки эндопротеза. В данных рекомендациях определена концентрация ионов кобальта и хрома, которая говорит о необходимости более пристального наблюдения за пациентом и требует выполнения лучевых методов исследования (МРТ и/или УЗИ). Пороговой концентрацией ионов металлов в цельной крови является 7 ppb (мкг/л), или 119 нмоль/л для кобальта и 134,5 нмоль/л для хрома. Для тотальных эндопротезов концентрация ионов металлов в крови пациентов ниже 7 ppb может быть связана с износом или коррозией неартикулирующих поверхностей. Решение о необходимости ревизии принимается в случае, когда определяются патологические изменения в области тазобедренного сустава по данным УЗИ или МРТ и/или повышена концентрация ионов кобальта и хрома в крови. Также данные изменения могут сочетаться со сниженной функцией тазобедренного сустава, определяемой с помощью шкалы Oxford.
Опубликованы данные регистра эндопротезирования суставов Англии, Уэльса, Северной Ирландии (National Joint Registry for England, Wales, Northern Ireland and the Isle of Man) по частоте ревизий эндопротезов тазобедренного сустава с парой трения металл-металл в связи с развитием острых реакций на металлический дебрис. Для полностью цементных эндопротезов она составляет за все время наблюдения – 8,49%, для бесцементных – 9,68%, для гибридных – 7,26%, для систем поверхностного протезирования – 3,89% [10].
Клиническое наблюдение
Мы представляем клиническое наблюдение: пациент Р., 51 года, который поступал на лечение в клинику РНИИТО с жалобами на боли в области левого тазобедренного сустава, хромоту на левую ногу, ограничение движений, связанное с болью, мышечную слабость. Боль возникала при малейшем движении и осевой нагрузке, которая усиливалась при длительных физических нагрузках.
Из анамнеза заболевания известно, что в 1989 году в результате ДТП у пациента случился перелом шейки правой бедренной кости, по поводу которого выполнен металлоостеосинтез пластиной и винтами. Через год в 1990 году выполнено удаление пластины и винтов. В дальнейшем у пациента развился посттравматический коксартроз 3 ст., асептический некроз головки бедренной кости, по поводу которого в 2002 году выполнено тотальное эндопротезирование левого тазобедренного сустава в одной из клиник Германии эндопротезом фирмы Zimmer с использованием пары трения металл-металл. Было использовано сочетание вертлужного компонента Lamella cup и бедренного компонента CLS, головка Metasul 28-4 мм. Послеоперационный период протекал без особенностей, и через два месяца пациент передвигался с полной нагрузкой на правую нижнюю конечность. В 2012 году – 2 эпизода падения на правый бок с интервалом в полгода. После падений за медицинской помощью пациент не обращался, для купирования болевого синдрома принимал НПВП и ходил на костылях около 1 месяца, далее – с полной нагрузкой, ограничения движений не отмечал. В 2015 году значительное усиление болевого синдрома, появление ограничения движений в правом тазобедренном суставе, ходьба с тростью даже на небольшие расстояния. При поступлении в клинику было выявлено, что компоненты эндопротеза были стабильны, однако отмечался выраженный остеолиз в области вертлужного компонента и проксимального отдела бедра (рис. 1).
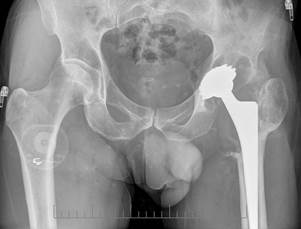
Рис. 1. Обзорная рентгенограмма таза пациента Р. при поступлении
При пункции сустава (в проекции левого тазобедренного сустава) было получено 5 мл синовиальной жидкости, в которой по результатам микробиологического исследования аэробные и анаэробные микроорганизмы не были обнаружены. По лабораторным показателям крови лейкоциты - 8,1*109/л, СОЭ - 34 мм/ч, СРБ -14,15 мг/л.
С целью определения локализации и размеров зон остеолиза была выполнена компьютерная томография правого тазобедренного сустава, по результатам определялись обширные зоны резорбции вертлужной впадины, окруженные тонким склеротическим ободком, шириной до 40 мм. Вокруг бедренного компонента в проксимальной трети обширная зона резорбции со вздутием и истончением кортикального слоя, однако за счет хорошей дистальной фиксации бедренный компонент оставался стабильным.
Согласно рекомендациям европейских обществ травматологов-ортопедов по ведению пациентов с эндопротезами тазобедренных суставов с парой трения металл-металл [8], было решено выполнить МРТ правого тазобедренного сустава, а также определение уровня ионов кобальта и хрома в крови пациента.
По данным МРТ была выявлена псевдоопухоль значительных размеров, поражающая как мягкие ткани, так и парапротезную кость (рис. 2).
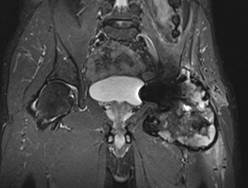
Рис. 2. МРТ тазобедренного сустава; псевдоопухоль больших размеров
Уровень ионов металлов в крови пациента был определен методом масс-спектрометрии с индуктивно-связанной плазмой. Концентрация ионов кобальта – 0,17 мг/л (0,10-0,40), ионов хрома – 0,51 мг/л (0,05-2,10). Таким образом, несмотря на огромные размеры псевдоопухоли, уровень ионов металлов оставался в пределах физиологической нормы.
Для визуализации взаимоотношений псевдоопухоли и магистральных сосудов была выполнена КТ-ангиография. По данным КТ-ангиографии связи псевдоопухоли с крупными сосудами не определялось, однако в связи с ее размерами посчитали нужным присутствие ангиохирурга, поскольку риск интраоперационного повреждения сосудов был высоким.
03.11.2017 выполнено ревизионное эндопротезирование левого тазобедренного сустава. Интраоперационно при доступе к суставу выделилось 40 мл синовиальной жидкости, которая была отправлена на микробиологическое исследование.
Псевдоопухоль располагалась вокруг вертлужного компонента, в области шейки эндопротеза и проксимального отдела бедренной кости. Данная псевдоопухоль была солидного характера, неоднородной структуры. Неоднородность структуры была обусловлена тем, что из-за своих больших размеров псевдоопухоль сдавливала мышцы и костные ткани, вызывая их разрушение. Было выполнено удаление псевдоопухоли в пределах здоровых тканей, в результате сформировались значительные дефекты мышц и костной ткани вокруг компонентов эндопротеза, однако компоненты эндопротеза оставались стабильными. Было решено произвести удаление вертлужного компонента с целью замены пары трения, бедренный компонент был оставлен. Выполнена имплантация вертлужного компонента бесцементной фиксации, дополнительно фиксированного тремя винтами (Trabecular Metal, Zimmer, Warsaw, IN 46580, U.S.A.) (рис. 3-5).
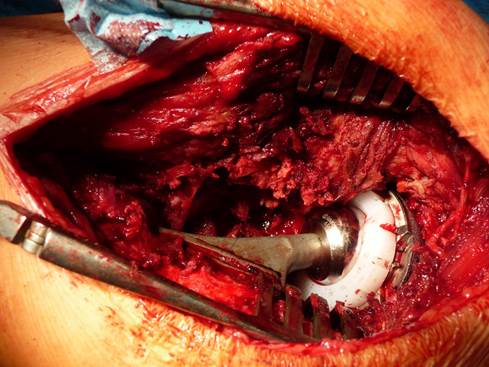
Рис. 3. Интраоперационный снимок. Псевдоопухоль вызвала повреждение мышц в области эндопротеза, а также выраженный остеолиз вокруг компонентов эндопротеза, которые оставались стабильными
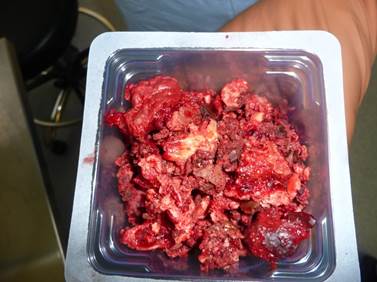
Рис. 4. Удаленная псевдоопухоль
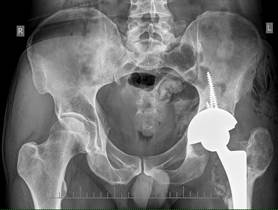
Рис. 5. Обзорная рентгенограмма таза после операции
Дальнейшее микробиологическое исследование жидкости, тканей и удаленного имплантата исключило инфекционный характер воспаления, а гистологический анализ образцов тканей показал, что материал представлен частично организованной гематомой. Вероятно, данное заключение обусловлено постоянной травматизацией сосудов в области эндопротеза, что способствовало увеличению размеров псевдоопухоли. Также в литературе представлено мало данных по гистологическому исследованию псевдоопухолей, поэтому необходимы дополнительные исследования для изучения их клеточного состава и реакций окружающих тканей.
Послеоперационный период протекал без особенностей, ограничение нагрузок на оперированную конечность было рекомендовано в течение 3 месяцев.
Функциональное состояние оперированных суставов оценивали по шкалам Harris, Oxford, WOMAC. До ревизионного эндопротезирования значения по вышеупомянутым шкалам составляли 32, 23 и 63 соответственно. Через шесть месяцев после ревизионного эндопротезирования сумма баллов по Harris составила 82, по Oxford 40, по WOMAC 20.
Обсуждение
Данный клинический пример в очередной раз показывает всю серьезность проблемы пары трения металл-металл и связанных с ее использованием специфических локальных осложнений в виде острых реакций мягких тканей на металлические частицы износа, наиболее опасной из которых является псевдоопухоль. При ее больших размерах в результате сдавления окружающих тканей возникают асептические некрозы мышц, остеолиз, высока вероятность сдавления крупных сосудов и нервов, в результате чего у пациентов развивается сильный болевой синдром и нарушение функции сустава. Более того, это создает большие проблемы при выполнении ревизионного протезирования. Во-первых, при удалении псевдоопухоли высока опасность повреждения сосудов и нервов, что требует проведения тщательного обследования пациента и предоперационного планирования. Во-вторых, важным вопросом является замещение костных дефектов, образующихся после удаления псевдоопухоли для достижения стабильной фиксации ревизионных компонентов эндопротезов. Дефекты мышц могут также потребовать выполнения пластических операций или установку конструкций для снижения вероятности вывихов (constrained или dual-mobility). Таким образом, важна своевременная диагностика специфических осложнений и замена пары трения для достижения хороших результатов ревизионного эндопротезирования.
Заключение
Данный клинический пример подтверждает необходимость проведения регулярного специального обследования пациентов с эндопротезами тазобедренного сустава с парой трения металл-металл, а также совершенствования алгоритма диагностики и критериев, позволяющих своевременно принимать решение о необходимости ревизионного эндопротезирования.
Конфликт интересов: не заявлен.



