Хронический миелолейкоз (ХМЛ) – клональное миелопролиферативное заболевание, характеризующееся реципрокной хромосомной транслокацией t(9;22) (q34;q11.2), в результате которой образуется филадельфийская хромосома (Ph) и химерный ген BCR-ABL, кодирующий белок p210BCR-ABL с высокой тирозинкиназной активностью [1]. Белок p210BCR-ABL отличается способностью к аутофосфорилированию, что приводит к полной автономности клетки и ее независимости от внешних механизмов регуляции [2]. По мере прогрессирования болезни в процесс вовлекаются и другие хромосомные абберации и мутации генов. Снижение чувствительности к апоптозу приводит к усиленной пролиферации и быстрому накоплению лейкемических клеток, повышенной миграции из костного мозга в периферическую кровь, а прогрессирующая геномная нестабильность многократно усиливает их онкогенный потенциал и является фактором прогрессии ХМЛ [3].
В своем развитии ХМЛ имеет 3 фазы: хроническую, фазу акселерации и бластного криза. В хронической фазе медиана выживаемости больных в среднем составляет 35-65 месяцев, в фазе акселерации - 12-24, а в фазе бластного криза – всего несколько месяцев [4]. Клиническая картина болезни от малосимптомной в хронической фазе резко ухудшается по мере прогрессии ХМЛ и в фазе акселерации и бластного криза характеризуется глубокой тромбоцитопенией с геморрагическими осложнениями, опухолевой интоксикацией. Основными причинами гибели пациентов в фазе бластного криза ХМЛ являются инфекционные, геморрагические осложнения, а также полиорганная недостаточность вследствие появления экстрамедуллярных очагов гемопоэза или прогрессирующей опухолевой интоксикации [5].
Хронический миелолейкоз – идеальная модель для изучения эффективности патогенетически направленной терапии. Именно при ХМЛ разработан специфический таргетный подход к лечению – воздействие на функционирование белка-тирозинкиназы p210BCR-ABL препаратом ингибитором тирозинкиназы (ИТК) - иматиниб-мезилат [1]. В основе его действия лежит блокирование участков тирозинкиназы, ответственных за связывание с АТФ, что приводит к нарушению передачи сигнала и остановке пролиферации или индукции апоптоза в клетках, экспрессирующих тирозинкиназу BCR-ABL. Применяемые ранее терапевтические средства (интерферон-a, гидроксимочевина, миелосан) значительно уступают эффективности иматиниба. Терапия иматинибом обеспечивает высокую общую пятилетнюю выживаемость больных в поздней хронической фазе (90,6%), при этом долгосрочная выживаемость объясняется высоким процентом достижения цитогенетического ответа (большого, малого, минимального в 93,7%). У пациентов, переживших 5-летний период, в 93% случаев не было зафиксировано прогрессирования в фазу акселерации или бластного криза [6]. В настоящее время во всем мире для подавляющего большинства больных ХМЛ иматиниб является препаратом 1-й линии терапии [1].
С появлением иматиниба появилась надежда полного излечения всех пациентов с ХМЛ. Однако долгосрочное исследование IRIS показало, что среди пациентов в хронической фазе ХМЛ, получивших лечение иматинибом без предшествующей терапии, у 4% после 3 месяцев лечения полная гематологическая ремиссия достигнута не была, а у 23% не удалось получить большой цитогенетический ответ, т.е. обнаружение не более 35% Ph-позитивных клеток, даже после 18 месяцев непрерывного приема иматиниба [6; 7]. Эти показатели расцениваются как признаки резистентности к препарату. Попытки восстановить химиочувствительность посредством увеличения дозы не всегда дают результат, а, напротив, нередко приводят к появлению признаков токсичности. В результате поисков путей преодоления резистентности к терапии иматинибом были созданы два препарата, ИТК второго поколения – нилотиниб и дазатиниб. ИТК второй линии подавляют активность клеток – носительниц мутантных форм ВCR-ABL-тирозинкиназы. При развитии резистентности к иматинибу применение ИТК второго поколения – нилотиниба и дазатиниба – позволяет снова получить полные гематологические ремиссии у 77-91% больных, а полные цитогенетические – у 41-53% больных [5; 8].
Целью настоящей работы явился анализ результатов терапии больных ХМЛ ингибиторами тирозинкиназ первой и второй линии в Ставропольском крае для дальнейшей оптимизации лечения данных пациентов.
Материалы и методы. В период с 2014 по 2016 г. изучены результаты обследования и лечения 123 пациентов с ХМЛ в возрасте от 21 до 84 лет (медиана 53 лет) в разных фазах заболевания, состоящих на учете в ГБУЗ СК «СККОД». Анализ результатов выполнен по текущим данным на август 2016 года. Диагноз и фаза ХМЛ устанавливались в соответствии с критериями ELN-2010 (European Leukemia Net) [4]. Пациентам после постановки диагноза ХМЛ назначался иматиниб в дозе 400 мг. При неудаче в лечении доза иматиниба повышалась до 600–800 мг в сутки. Динамику ответа на терапию определяли на основании клинических данных, показателей общего и биохимического анализов крови (1 раз в неделю в течение первого месяца, далее ежемесячно), цитогенетического исследования костного мозга (через первые 3 месяца, далее каждые 6 месяцев) и уровня экспрессии гена BCR-ABL по данным полимеразной цепной реакции (ПЦР) через первые 3 месяца после констатации полного цитогенетического ответа (ПЦО) и далее каждые 6 месяцев [9]. Эффективность терапии оценивали по частоте гематологических, цитогенетических и молекулярно-генетических ответов, их стабильности и показателям выживаемости. Полный гематологический ответ (ГО) определяли по следующим критериям: отсутствие клинических симптомов заболевания, стабилизации показателей периферической крови (лейкоциты <9х109/л, тромбоциты >100х109/л), нормализации размеров селезенки [3]. Цитогенетический ответ (ЦО) устанавливали по числу Ph-позитивных клеток костного мозга: полный – 0%, частичный – 1–34%, малый – 36–65%, минимальный – 66–95%. Полный молекулярно-генетический ответ (МО) достигался в отсутствие транскрипта BCR-ABL, большой – при снижении уровня в 1000 раз по сравнению уровнем экспрессии BCR-ABL до начала терапии. Безопасность и переносимость препаратов оценивались согласно шкале токсичности Common Toxicity Criteria NCIC. В случаях недостижения полного гематологического ответа, при потере полного цитогенетического ответа, при непереносимости иматиниба или при трансформации болезни в фазу акселерации больные по возможности переводились на ИТК 2-го поколения: нилотиниб 600/800 мг в сутки или дазатиниб 100/140 мг в сутки. Перед назначением ИТК 2-го поколения исследовались мутации гена ВСR-ABL, при выявлении которых отдавалось предпочтение в назначении препарата.
Результаты. На август 2016 г. в Ставропольском крае зарегистрировано 123 пациента с ХМЛ, из них мужчин – 69, женщин – 54 человека. В Ставрополе проживает 40 пациентов с ХМЛ (32,5%), в городах и селах края 83 пациента (67,5%). У мужчин средний возраст составил 51,5 ± 2,3 года, женщин – 53,7 ± 2,7 года. Хроническую фазу заболевания на момент постановки диагноза имели 85 пациентов (69%), фазу акселерации – 38 больных ХМЛ (39%). Продолжительность заболевания от начала таргетной терапии до момента наблюдения была от 6 до 120 месяцев (медиана 62 месяцев).
ИТК 1-го поколения – иматиниб - назначался в дозе 400 мг при хронической фазе заболевания, в дозе 600 мг – в фазе акселерации. Гематологический ответ на терапию развивался в среднем через 1 месяц. После достижения гематологического ответа у 25 пациентов доза иматиниба был снижена до средней терапевтической (400 мг). Медиана достижения цитогенетического ответа на ИТК-1 составила 20 месяцев, молекулярного ответа – 30 месяцев. Мы проанализировали эффективность терапии у 74 пациентов, получавших иматиниб более 12 месяцев. Среди них полный цитогенетический ответ имелся у 35 пациентов (47,3%), а у 30 (40,5%) – полный молекулярный ответ. Доза иматиниба была эскалирована до 800 мг 20 больным, при этом у 6 (30%) пациентов имеется большой цитогенетический эффект, и только у 3 (15%) пациентов получен большой молекулярный ответ.
Иматиниб хорошо переносился пациентами. Из нежелательных явлений встречались периферические отеки (26%), тошнота (23%), диарея (12%), тромбоцитопения (1,6%). Побочные реакции наблюдались в первые 1,5 года терапии, степень токсичности не превышала II и не требовала отмены или снижения дозировки препарата.
К моменту исследования 8 пациентов принимали ИТК 2-го поколения. Основными причинами для перевода на ИТК 2-го поколения стали: отсутствие гематологического ответа (25%), потеря цитогенетического ответа (75%), бластный криз (25%), мутации в гене ВСR-ABL (50%). Ниже представлены данные пациентов, находившихся на терапии ИТК 2-го поколения (таблица).
Терапия ингибиторами тирозинкиназ второго поколения у пациентов с хроническим миелолейкозом в Ставропольском крае
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Пол |
ж |
м |
ж |
м |
м |
м |
м |
ж |
|
возраст |
56 |
68 |
38 |
50 |
55 |
51 |
58 |
36 |
|
начало ХМЛ |
2013 |
2011 |
2011 |
2005 |
2008 |
2009 |
2014 |
2014 |
|
ИТК-1, мес. |
6 |
43 |
36 |
60 |
78 |
64 |
14 |
6 |
|
причина перехода на ИТК-2 |
отсутст-вие ЦО |
потеря ГО, мутация F317L |
потеря ГО мутация V299L |
потеря ГО |
потеря ГО, БК |
потеря ГО, БК |
потеря ЦО, мутация Y253H |
потеря ГО, мутация Y253H |
|
ИТК-2, мес. |
нило-тиниб, 30 |
нило-тиниб, 24 |
нило-тиниб, 20 |
нило-тиниб, 36 |
даза-тиниб, 12 |
даза-тиниб, 8 |
даза-тиниб, 15 |
даза-тиниб, 12 |
|
ответ на терапию, мес. |
ГО, 1 ПЦО, 13 БМО, 15 |
ГО, 1 ЧЦО, 16 |
ГО, 1 ПЦО, 13 БМО, 19 |
ГО, 1 ЧЦО, 15 |
ГО, 2 ПЦО, 6 БМО, 8 |
ГО, 2 БК, 6 |
ГО, 1 ЧЦО, 14 |
ГО, 1 ЧЦО, 11 |
|
причина перехода на ИТК-2 |
потеря ЦО |
потеря ЦО, мутация F317L |
||||||
|
ИТК-2, мес. |
даза-тиниб, 30 |
нило-тиниб, 2 |
||||||
|
ответ на терапию, мес. |
БК, мутация Т315I |
ГО, 1 БК, 3 |
Примечание: ИТК-1 – ингибиторы тирозинкиназ 1-го поколения, ИТК-2 – ингибиторы тирозинкиназ 2-го поколения, БК – бластный криз, ГО – гематологический ответ, ЦО – цитогенетический ответ, ПЦО – полный цитогенетический ответ, ЧЦО – частичный цитогенетический ответ, БМО – большой молекулярный ответ.
Средний возраст пациентов составил 52,8 года. Длительность заболевания ХМЛ колебалась от 1,5 до 12 лет. Пациенты находились на лечении иматинибом от 6 до 78 месяцев. Суточная дозировка препаратов варьировала от 400 до 800 мг. Всем пациентам ИТК-2 поколения были назначены в фазу акселерации или бластного криза. По возможности при переходе или смене ИТК 2-го поколения оценивался мутационный статус.
Через 1-2 месяца от начала лечения ИТК 2-го поколения у всех больных ХМЛ зарегистрирован гематологический ответ.
При назначении нилотиниба полный цитогенетический ответ достигнут через 13 месяцев у 2 пациентов, частичный цитогенетический ответ через 16 месяцев 2 пациентов. Трое пациентов в настоящее время продолжают терапию нилотинибом. У одного пациента с длительной предлеченностью (более 8 лет) на фоне терапии нилотинибом цитогенетический ответ был утерян. Пациент переведен на терапию дазатинибом, был получен гематологический ответ. Однако через 2,5 года терапии у больного развился бластный криз. При оценке мутационного статуса выявлена мутация T315I, свидетельствующая о резистентности к ИТК 2-го поколения.
Все пациенты отмечали хорошую переносимость препарата. Из побочных явлений отмечались нейтропения I степени у одной пациентки, транзиторное повышение уровня глюкозы у 2 пациентов, не потребовавшее медикаментозной коррекции.
Из 4 пациентов, получавших дазатиниб, полный цитогенетический ответ достигнут через 6 месяцев у 1 пациента, частичный цитогенетический ответ у 2 пациентов через 14 и 11 месяцев соответственно. Двое пациентов в настоящее время продолжают терапию дазатинибом. Двое пациентов были переведены на дазатиниб в фазе бластного криза на фоне лечения ИТК 1-го поколения. Из них у одного пациента гематологический ответ был достигнут через 2 месяца, однако через 6 месяцев от начала терапии зарегистрирован повторный бластный криз. У второго пациента на фоне терапии дазатинибом достигнут полный цитогенетический ответ через 6 месяцев от начала терапии, большой молекулярный ответ через 8 месяцев. Однако через год от начала лечения цитогенетический ответ был утерян, выявлена мутация F317L, пациент переведен на нилотиниб. Несмотря на смену терапии через 3 месяца развился бластный криз.
При лечении нилотинибом у 2 пациентов развилась нейтропения II степени. Учитывая длительный период предлеченности этих пациентов, нельзя исключить, что цитопения была обусловлена прогрессированием заболевания. У одного пациента через год от начала лечения дазатинибом в дозе 140 мг развился плевральный выпот, потребовавший проведения пункции плевральной полости и медикаментозной коррекции (мочегонные препараты, глюкокортикоиды). Возникновение плеврального выпота было, скорее всего, связано с высокой дозой препарата [1].
На момент исследования выживаемость у больных с ХМЛ, принимающих ингибиторы тирозинкиназ, составила 96% (рисунок). Все умершие больные погибли в фазу бластного криза, из них у одного пациентов имелась мутация гена ВСR-ABL Т315I. Выживаемость без прогрессии зарегистрирована у 68% больных с ХМЛ. Чаще трансформация в фазу акселерации и бластного криза происходила в первые три года, а у двух пациентов – на шестом году заболевания. Бессобытийная выживаемость (потеря полного гематологического, полного цитогенетического, полного и большого молекулярного ответов, смерть) составила 45%.
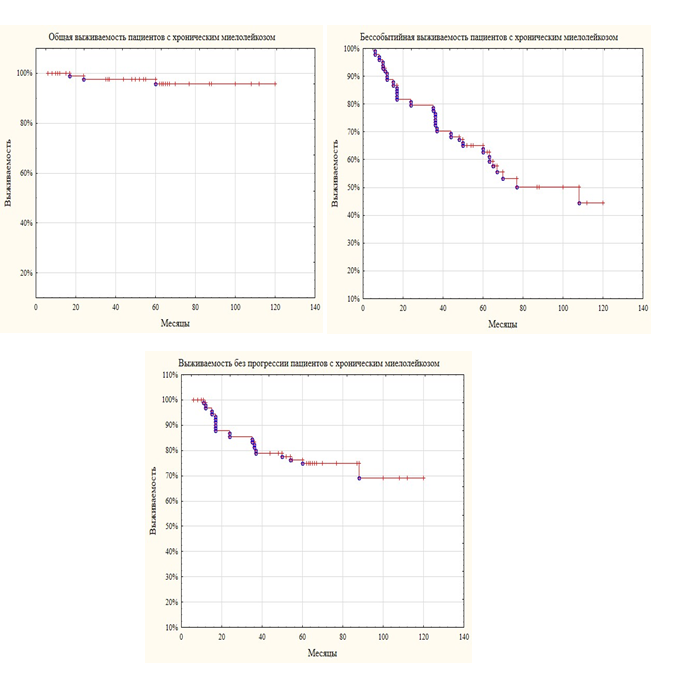
Показатели выживаемости пациентов с хроническим миелолейкозом
Обсуждение. Заболеваемость ХМЛ в Ставропольском крае составляет 0,9-1,1 случая на 100 000 населения, с небольшим преобладанием мужчин 1,3:1, более половины пациентов заболевают в возрасте 45-55 лет. Эпидемиологические данные совпадают с данными по России и несколько меньше по сравнению с мировой статистикой [3; 9]. Большинству пациентов диагноз устанавливался в хроническую фазу. При лечении иматинибом полные клинико-гематологические ремиссии в ранние сроки (1 месяц) наблюдались у всех ранее не леченых пациентов, что подтверждается литературными данными [10] и свидетельствует о высокой эффективности ИТК 1 поколения в хронической фазе заболевания.
При оценке сроков и частоты достижения цитогенетического и молекулярного ответов выяснилось, что полученные нами данные значительно уступают результатам мировых исследований. Так, согласно исследованиям IRIS частота молекулярных ремиссий в течение первого года лечения иматинибом составляла 40%, а после 54 месяцев наблюдения у 93% больных не было признаков цитогенетического рецидива [6]. Нами было установлено, что молекулярно-генетическое исследование в первый год лечения ИТК проводилось в среднем 2 раза, во второй и последующие годы – в среднем 1 раз в год, причем в структуре пациентов преобладали жители края. Оценивая комплаентность пациентов, т.е. неукоснительное соблюдение режима лечения, мы выяснили, что после достижения гематологического ответа 93% пациентов продолжали принимать иматиниб в рекомендуемых дозировках, а через 1 год от начала терапии – 84%. Несоблюдение рекомендуемых сроков регулярного мониторинга, а также приверженности пациентов к лечению, возможно, повлияли на более поздние сроки наступления и снижение частоты достижения ответов у пациентов с ХМЛ.
Увеличение дозы препарата, как и ожидалось [10; 11], не привело к значимому увеличению цитогенетического и молекулярного ответа. Эскалацию дозы ИТК 1-го поколения следует считать фактором риска прогрессирования процесса, поэтому пациенты, принимающие иматиниб 600–800 мг в сутки, могут рассматриваться как кандидаты перевода на ИТК 2-го поколения [9].
Согласно рекомендациям ELN-2010 по лечению ХМЛ 35% больным показано назначение препаратов 2-й линии. К моменту исследования лишь 8 пациентов принимали ИТК 2-го поколения. Как правило, назначение препаратов было обусловлено либо неудачей длительного лечения высокими дозами иматиниба, либо трансформацией заболевания в фазу бластного криза. У 5 из 8 пациентов были достигнуты цитогенетические ремиссии (62,5%). Трое пациентов погибло, причем у 2 пациентов переключение на ИТК 2-й линии произошло в фазу бластного криза, а у одного пациента выявлена мутация Т315I, определяющая резистентность к любым ингибиторам тирозинкиназ. Результаты лечения наших пациентов ИТК 2-го поколения по частоте достижения полного гематологического ответа и двухлетней выживаемости пациентов сопоставимы с данными международных рандомизированных исследований [7; 10]. Достижение полного цитогенетического и полного молекулярного ответов гораздо ниже, и мы расцениваем это как результат позднего назначения ИТК 2-го поколения.
Ингибиторы тирозинкиназ хорошо переносятся пациентами. Все зарегистрированные нами случаи нежелательных явлений не превышали II степени и не требовали отмены препаратов.
Согласно литературным данным, семилетняя выживаемость пациентов, находящихся на таргетной терапии, превышает 90%, при этом у 93% больных, переживших 7-летний рубеж, не наблюдается прогрессирования в фазу акселерации или бластный криз [6]. Бессобытийная выживаемость составляет 75% [12]. В нашем исследовании общая двухлетняя выживаемость оказалась сопоставимой, однако выживаемость без прогрессии оказалась ниже, что, вероятно, связано с недостаточным мониторингом пациентов с ХМЛ, и как следствие, несвоевременным назначением ИТК 2-го поколения.
Заключение. Современная терапия ингибиторами тирозинкиназ первой и второй линии дает возможность подавляющему числу больных ХМЛ прожить не менее чем 7-летний период, сохраняя высокое качество жизни. С целью оптимизации результатов лечения необходим четкий цитогенетический и молекулярный мониторинг пациентов в установленные сроки, своевременное переключение больных на ИТК 2-го поколения, а также повышение комплаентности пациентов к длительному лечению путем актуализации школ для пациентов с ХМЛ.



