Острое повреждение спинного мозга является одной из наиболее актуальных проблем современной медицины, так как сопровождается грубыми неврологическими расстройствами, приводит к развитию тяжелых осложнений, обладает крайне низким реабилитационным потенциалом, что обусловливает высокий уровень инвалидизации у данной категории пациентов [1-3].
Ключевой причиной неблагоприятного прогноза (в отношении восстановления неврологического дефицита) у пациентов с острым повреждением спинного мозга является формирование глиального рубца на месте очага повреждения ткани спинного мозга [1; 2]. В формировании глиозной трансформации спинного мозга участвуют микроглиоциты, предшественники олигодендроцитов, менингеальные клетки, астроциты (основные клетки глиального рубца) и стволовые клетки [2; 11]. Глиальный рубец является как механическим, так и молекулярным (за счет синтеза веществ, тормозящих рост аксонов) барьером для регенерации аксонов дистально от очага повреждения, а его формирование служит универсальным ответом центральной нервной системы (ЦНС) на повреждение [2; 11].
Используемые в начальный период острого повреждения ЦНС нейропротективные и глиопротективные препараты, главной целью назначения которых является стимуляция регенерации ЦНС, будут неизбежно воздействовать на формирование глиального рубца и едва ли способны стимулировать эффективную регенерацию аксонов и ремиелинизацию проводящих путей ЦНС [2; 11].
Разработка препаратов, способных затормозить образование глиального рубца, является перспективным направлением современной медицинской науки в связи с тем, что данные средства способны значительно повысить реабилитационный потенциал данной категории пациентов [1; 2]. В качестве средства, способного ограничить пролиферативную активность глии в области очага повреждения спинного мозга, нами предложен D-аспарагин (правовращающий изомер амида аспарагиновой кислоты) [8].
Организм для своей жизнедеятельности использует преимущественно левовращающие изомеры аминокислот, содержание правовращающих изомеров во внутренних средах организма в целом не превышает 1% [7; 9]. У млекопитающих D-аспарагиновая кислота (D-аспартат) определяется в нервной ткани (особенно у эмбриона и плода), эритроцитах, железах внутренней секреции, хрусталике, дентине, кости, коже, легких и соединительной ткани [7; 9; 17].
Источниками D-аспартата у млекопитающих являются пища, деятельность кишечной микрофлоры, спонтанная рацемизация (наблюдается рост содержания в составе белков организма по мере его старения), а также действие специфической аспарагиновой изомеразы, синтезирующей соответствующую аминокислоту для покрытия потребностей организма [12; 13; 17].
D-аспартат обладает выраженной биологической активностью: в ЦНС влияет на NMDA–обусловленную нейропередачу, участвует в секреции гормонов (тестостерона, окситоцина, мелатонина, соматотропина, лютеинизирующего гормона и других), важную роль играет в развитии тканей в ходе онтогенеза [22].
В целом правовращающие изомеры аминокислот, несмотря на ряд выполняемых физиологических функций, токсичны для большинства организмов, в том числе и для млекопитающих. В основе антиметаболических свойств D-аминокислот лежит как специфическая токсичность, характерная для отдельных представителей (D-цистеина, D-тирозина, D-фенилаланина), так и неспецифические метаболические нарушения, возникающие при использовании вместо левовращающих, правовращающих изомеров аминокислот [12; 13; 17]. Накопление остатков правовращающих аминокислот в составе структурных белков организма при старении негативно сказывается на их функциональной активности [12; 13].
При добавлении D-аспарагина в рацион крыс обнаружено значительное торможение их роста, что обусловлено ингибированием специфических трансаминаз и лактат-дегидрогеназы [10]. В частности, in vitro показано торможение деления опухолевых клеток под влиянием D-аспартата [20].
Ключевым механизмом токсического действия D-аминокислот является торможение белкового синтеза за счет аминоацилирования тРНК, что подтверждается значительным его усилением при инактивации, либо низкой экспрессии D-аминоацил-тРНК дезацилазы [17; 23]. Важное значение имеет способность аспартил-тРНК синтетазы распознавать D-аспартат, что препятствует его включению в состав белков [4; 17].
Основным способом инактивации D-аспартата у млекопитающих является деятельность фермента D-аспартат-оксидазы, благодаря чему содержание D-аспартата поддерживается на безопасном для организма уровне [10; 17-19; 22].
D-аспартат, накапливающийся в составе белков в результате спонтанной рацемизации остатков L-аспартата, может восстанавливать свою исходную хиральную форму с помощью фермента L-изоаспартат (D-аспартат) О-метил-трансферазы либо реакций спонтанного деметилирования. Функционирование данного фермента критично для нормального деления и дифференцировки клеток, а также нормального функционирования ЦНС [16; 17].
В то же время известно, что D-аспарагин способен затормозить пролиферацию незрелых клеток, что обусловлено низкой экспрессией в них ферментов, его обезвреживающих [10; 17].
Антипролиферативные свойства D-аспарагина можно сравнить с эффектом при использовании цитостатической терапии, однако по тяжести побочных действий D-аспарагин не сопоставим с ней [6].
Цель исследования – изучить влияние D-аспарагина на формирование глиозной трансформации спинного мозга в эксперименте у крыс с моделью спинального инсульта.
Материалы и методы исследования
Исследование выполнено в лаборатории кафедры общей и клинической патологической физиологии ФГБОУ ВО «КубГМУ». Эксперименты проведены на 60 белых нелинейных крысах-самцах средней массой 346±75 г. Содержание животных и постановка экспериментов соответствовали требованиям Приказа МЗ РФ от 01.04.2016 года № 199, а также международными правилами «Guide for the care and use of the laboratory animals».
Все животные были разделены на 3 группы: контрольную – 20 интактных крыс с невредимым спинным мозгом; группу сравнения – 20 крыс, которым воспроизводили фокальный фототромбоз кровеносных сосудов грудного отдела спинного мозга с последующим изъятием участка спинного мозга на 17-е сутки; опытную группу – 20 животных, которым выполнялось моделирование спинального инсульта с последующим введением D-аспарагина с 3-х по 6-е сутки эксперимента и изъятием спинного мозга на 17-е сутки.
Крысам группы №3 внутривенно вводили в вену хвоста 0,5%-ный раствор D-аспарагина, приготовленного на воде для инъекций. Курсовая доза D-аспарагина составила 21,7 мг/кг.
Моделирование спинального инсульта проводили по модифицированной методике M. Von Euler путем инициирования фототромбоза сосудов грудного отдела спинного мозга лазером с длиной волны 514 нм, в качестве фотосенсибилизатора использован эритрозин, для ингибирования фибринолиза применялась транексамовая кислота [8; 21]. Операцию выполняли под золетил-ксилазиновым наркозом – золетил 3 мг/кг в/м (Virbac, Франция), ксиланит 8 мг/кг в/м (ЗАО «НИТА-ФАРМ», Россия, г. Саратов), атропина сульфат 0,1 мг/кг п/к [5].
Крыс выводили из опыта на 17-е сутки эксперимента путём введения в золетил-ксилазиновый наркоз с последующей декапитацией. Забор спинного мозга проводили методом его выталкивания фосфатным буфером, вводимым в объеме 10 мл через канюлю шприца, вставленную в поясничный отдел позвоночника [14]. Извлеченный спинной мозг помещали в цинк-формалиновый фиксатор с сульфатом цинка [15]. Выполняли проводку полученных образцов через изопропанол-минеральное масло с последующей их заливкой в парафин. Парафиновые блоки нарезали на срезы толщиной 10 мкм на микротоме МПС-2 (CCCP). Окрашивание микропрепаратов проводили гематоксилином и эозином. Для фотографии микропрепаратов использовали микроскоп «Микмед-5» (Россия) и окулярную камеру Levenhuk-230 (США). Анализ фотографий микропрепаратов осуществляли с помощью фоторедактора GIMP2. Используя инструмент «сетка», проводили подсчет клеток по ячейкам наложенной на фото сетки, ячейки которой предварительно были откалиброваны с помощью объект-микрометра.
Статистическую обработку полученных данных проводили с использованием программного обеспечения Statistica 10 version фирмы Stat Soft Inc. Для проверки гипотезы о гауссовом (нормальном) распределении показателей в исследуемых группах использовали критерий Шапиро-Уилка. В связи с тем что распределение значений исследуемых показателей в группах отличалось от нормального, их сравнение проводилось по непараметрическому критерию Колмогорова-Смирнова с установлением уровня значимости *p≤0,05. Полученные результаты статистической обработки выражали в виде медианы (Me) с использованием 25 и 75 процентилей (p25 и p75) и доверительного интервала 95 (ДИ 95).
Результаты исследования и их обсуждение
Случаев незапланированной гибели животных в ходе эксперимента зарегистрировано не было. При исследовании микропрепаратов спинного мозга крыс контрольной группы в области прохождения разреза отчетливо прослеживаются продольные пучки проводящих путей (рис. 1, 2).
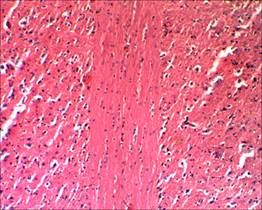
Рис. 1. Проводящие пути на продольном срезе спинного мозга интактных крыс, х100. Окраска гематоксилин–эозином
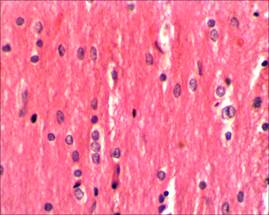
Рис. 2. Ядра олигодендроцитов на продольном срезе спинного мозга интактных крыс, х400. Окраска гематоксилин–эозином
На микропрепаратах спинного мозга крыс группы сравнения (без применения D-аспарагина) на 17-е сутки от начала спинального инсульта прослеживаются явления выраженной глиозной трансформации спинного мозга. В области проводящих путей наблюдается большое скопление клеток глии (предположительно астроцитов), образующих ячеистые структуры, что свидетельствует о наличии процесса формирования глиального рубца в области очага фототромбоза сосудов спинного мозга (рис. 3, 4).
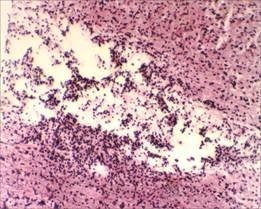
Рис. 3. Глиозная трансформация спинного мозга у крыс группы сравнения, х100
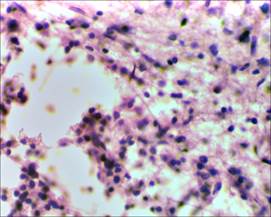
Рис. 4. Глиозная трансформация спинного мозга у крыс группы сравнения х400
При сравнении микропрепаратов спинного мозга крыс контрольной группы и группы сравнения (табл.) оказалось, что на 17-е сутки от начала спинального инсульта количество клеток глии в области очага фототромбоза в микропрепаратах группы сравнения (без применения D–аспарагина) в 3 раза превышало их количество в срезах спинного мозга крыс контрольной группы (p≤0,001). Это свидетельствует об активном течении процесса глиозной трансформации на месте очага фототромбоза.
Численность клеток глии в области очага фототромбоза спинного мозга крыс группы сравнения и опытной группы на 17-е сутки эксперимента
|
Статистические показатели |
Контрольная группа |
Группа сравнения |
Опытная группа |
|
Me |
3 |
9 |
3,5 |
|
p75 |
5 |
13 |
6 |
|
p25 |
3 |
8,5 |
2,5 |
|
ДИ, 75 |
2,9-5,3 |
7,7-14 |
2,8-5,0 |
|
Критерий Колмогорова-Смирнова |
- |
p≤0,001 |
p≥0,01 |
|
- |
- |
p≤0,01 |
На 17-е сутки от начала моделирования спинального инсульта на микропрепаратах спинного мозга крыс основной группы (с применением D-аспарагина) визуализируется небольшой очаг глиоза, который незначительно нарушает ход проводящих путей; при этом в области очага фототромбоза сосудов грудного отдела спинного мозга, в сравнении с микропрепаратами спинного мозга крыс группы сравнения (без применения D-аспарагина), видно значительно меньшее количество клеток глии, прослеживаются отдельные аксоны, проходящие сквозь область формирующегося глиального рубца, что является свидетельством эффективности применения D-аспарагина (рис. 5, 6).
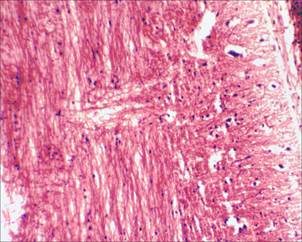
Рис. 5. Очаг глиоза спинного мозга у крыс основной группы, х100
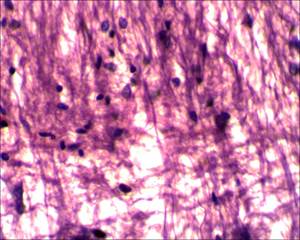
Рис. 6. Очаг глиоза спинного мозга у крыс основной группы, х400
При сравнении численности клеток на микропрепаратах в области очага фототромбоза спинного мозга крыс группы сравнения (D-аспарагин не применялся) и основной группы (использован D-аспарагин в курсовой дозе 21,7 мг/кг) видны значительные различия. Плотность распределения клеток глии в очаге фототромбоза на микропрепаратах спинного мозга у крыс основной группы (получали D-аспарагин) была в три раза ниже, чем у крыс группы сравнения (без D-аспарагина) (p≤0,01).
Таким образом, плотность распределения клеток в области очага фототромбоза спинного мозга на микропрепаратах крыс основной группы (получали D-аспарагин) приближается к величине показателя, полученного в контрольной группе, то есть статистически значимой разницы в количестве клеток глии спинного мозга крыс контрольной и основной групп не выявлено (p≥0,01).
Выводы
Фототромбоз сосудов грудного отдела спинного мозга, инициированный лазером с длинной волны 514 нм в сочетании с использованием эритрозина (в качестве фотосенсибилизатора) и транексамовой кислоты (в качестве ингибитора фибринолиза), к 17-м суткам от момента воспроизведения патологии приводит к выраженной глиозной трансформации поврежденного участка спинного мозга. Внутривенное введение 0,5%-ного раствора D-аспарагина в курсовой дозе 21,7 мг/кг с 3-х по 6-е сутки от начала экспериментального спинального инсульта, по данным гистологического исследования спинного мозга, способствует тому, что на 17-е сутки течения патологии значительно уменьшается выраженность процессов глиозной трансформации. Эксперимент свидетельствует о перспективности дальнейшего изучения влияния D-аспарагина на течение и исходы повреждений спинного мозга, так как демонстрирует возможности значительного повышения потенциала купирования неврологического дефицита.



