Одной из основных задач анестезиологии является создание максимально комфортных условий работы для хирурга при условии наиболее эффективной защиты пациента от всех неблагоприятных факторов операции, включая и не связанные непосредственно с хирургической травмой [1]. Наиболее актуальной эта проблема является в амбулаторной хирургии, когда ранняя послеоперационная реабилитация пациента не только улучшает прогноз, но и приносит значительный экономический эффект. Специфической особенностью офтальмохирургических операций является высокая доступность и эффективность наиболее безопасных регионарных и местных методов анестезии [2]. В связи с этим, на первый план в работе анестезиолога в офтальмологии выступает задача защиты пациента от психологического стресса периоперационного периода при сохранённом сознании. Реализуется эта задача концепцией упреждающей аналгезии и седации [3]. Упреждающая аналгезия и седация предупреждает сенситизацию путей проведения боли и болевых центров, благодаря чему сокращается последующее восприятие боли. Введение 1-й дозы НПВС за 20–30 мин до кожного разреза считается оптимальным для обеспечения предупреждающей анальгезии [4]. Однако получасовой интервал ожидания эффекта медикаментов в условиях высокопоточных технологий оказания хирургической помощи, как в МНТК «Микрохирургии глаза», будет увеличивать продолжительность работы операционного стола с прогрессирующей задержкой последующих операций. Предварительное же введение НПВС в отделении может оказаться малоэффективным вследствие слабопрогнозируемого времени вызова пациента в операционную [5, 6].
Практически каждый внутривенный анестетик и внутривенный гипнотик имеют определённые недостатки и нежелательные эффекты, что создаёт необходимость поиска рациональных комбинаций ЛС, позволяющих получать оптимальный результат. Классический стандарт внутривенных анестетиков – морфин, как и все опиаты, несмотря на высокий анальгетический эффект, может вызывать пролонгированную депрессию дыхания, брадикардию, особенно опасные у пожилого контингента пациентов; миоз, затрудняющий работу хирурга, а также тошноту и рвоту, повышающие риск осложнений при полостных офтальмохирургических вмешательствах. Кроме того, после первоначальной активации антиноцицептивной системы опиоидами затем вызывается стойкая активация ноцицептивной системы, что способствует формированию отсроченной гипералгезии. Воздействие на μ-опиатные рецепторы инициирует активацию NMDA-рецепторов за счет удаления блокирующих ионов Mg2+ из их рецепторных каналов [7]. Стандарт внутривенных гипнотиков – бензодиазепины – у пожилых пациентов опасны плохо управляемым гипнотическим эффектом, который в сочетании с антероградной амнезией может привести к внезапному пробуждению пациента при непреднамеренном «углублении» седации с двигательной активностью во время операции, что чревато грозными осложнениями при полостных вмешательствах [5, 8]. Расположение бензодиазепиновых рецепторов вблизи ГАМК-рецепторов способствует повышению активности тормозящего нейтротрансмитгера (ГАМК) при применении бензодиазепинов. Немаловажным является и известный риск «бензодиазепиновых» психозов [9]. Учитывая вышеизложенное, в нашей практике у пожилых пациентов мы практически отказались от бензодиазепинов и морфина, как в премедикации, так и во время анальгоседации, в пользу трамадола. Трамадол относится к анальгетикам смешанного механизма действия (опиоидный и неопиоидный компоненты), седативный эффект этого препарата (особенно в сочетании с суберапевтическими дозами дроперидола) в большинстве случаев оказывается достаточным для создания комфортных условий для пациентов во время оперативного вмешательства.
В связи с более широким распространением амбулаторной хирургии внимание привлек новый неопиоидный анальгетик центрального действия – нефопам [RCP Acupan® (néfopam) – Révisionjuin 2007]. Его центральное обезболивающее действие основано на ингибировании обратного захвата дофамина, норадреналина и серотонина на уровне синапсов [10]. Анальгезирующая активность нефопама также объясняется возможным снижением высвобождения глутамата на пресинаптическом уровне и активацией NMDA-рецепторов на постсинаптическом уровне [11]. Сочетание его антиноцицептивных и антигипералгезических свойств с отсутствием свойственной опиатам способности вызывать депрессию дыхания, тошноту имиоз, делает нефопам препаратом выбора в «хирургии одного дня». Особую привлекательность для офтальмоанестезиологии имеет м-холиноблокирующее действие препарата, позволяющее хирургу значительно уменьшить дозу мидриатиков для достижения оптимального оперативного доступа (максимального расширения зрачка) и, следовательно, уменьшить риск развития токсических системных эффектов.
Синергическое действие нефопама и НПВС, в частности, кетопрофена, показано как в эксперименте, так и в клинике при мультимодальной анальгезии [12]. Однако в настоящее наряду с повышенной кровоточивостью, почечной патологией и язвенными поражениями ЖКТ, противопоказаниями к назначению НПВС считаются пожилой возраст пациентов, а также перенесенный ОИМ и АКШ в анамнезе. В то же время основной контингент пациентов в офтальмохирургии составляют люди в возрасте старше 65 лет, что значительно сужает показания к использованию НПВС в составе мультимодальной анальгезии [13, 14]. Исследование Tramoni G et al. (2003) показало очевидное преимущество сочетания нефопама с парацетамолом в составе послеоперационной анальгезии [15].
Цель работы: сравнение эффективности и безопасности анестезиологического пособия в офтальмохирургии при использовании нефопама в сочетании с НПВС или трамадола в качестве анальгетиков для упреждающей аналгезии и седации.
Материал и методы. Для доказательства эффективности и безопасности применения нефопама (акупана) в составе аналгоседации с сохраненным сознанием проведено проспективное сравнительное исследование течения анестезии в трёх группах пациентов, которым выполнялись антикатарактальные или антиглаукоматозные хирургические вмешательства на фоне субтеноновой регионарной анестезии.
В зависимости от методики анестезии пациенты были распределены на 3 группы:
- группа с использованием акупана и кеторолака (кетанова) (Ак+К), n = 47;
- группа с использованием акупана и парацетамола (перфалгана) (Ак+П), n = 85;
- контрольная группа с использованием трамадола (Тр), n = 53.
Критериями включения в группу были: планируемая операция по поводу катаракты или глаукомы; возраст от 40 до 85 лет; соматический статус I-III по ASA. Критерии исключения: электрическая нестабильность миокарда в анамнезе, исходная артериальная гипертензия в операционной >180/100 мм рт. ст.; паркинсонизм или эпилепсия в анамнезе и хирургические осложнения, потребовавшие углубления анестезии. Группы однородны по полу, возрастному составу, длительности операции и сопутствующей патологии (табл. 1).
Таблица 1
Общая характеристика пациентов
|
Характеристика |
1-я группа (Ак+К) |
2-я группа (Ак+П) |
3-я группа (Тр) |
|
Число пациентов |
47 |
85 |
53 |
|
Возраст |
68,9±8,2 |
70,2±6,3 |
69,8±7,8 |
|
Пол(м/ж) |
19/28 |
32/53 |
19/33 |
|
Продолжительность операции (мин) |
22,1±5,8 |
23,4±9,5 |
22,9±7,7 |
Основной сопутствующей патологией были ИБС, гипертоническая болезнь, хроническая сердечная недостаточность, дисциркуляторная энцефалопатия, ожирение и ХНЗЛ.
Премедикация во всех группах проводилась пероральным назначением атаракса (гидроксизина гидрохлорида) 25 мг утром и вечером и лоратадина 10 мг утром накануне операции.
Пациентам 1-й группы (Ак+К) – 47 человек – внутривенно вводился акупан в сочетании с НПВС – кеторолаком 30 мг. Учитывая возрастной контингент пациентов и механизм действия акупана – ингибирование обратного захвата моноаминов, разовая доза препарата была уменьшена до 10 мг (0,12 мг/кг – стандартная для 1-ой и 2-ой групп), вторичный катехоламиновый эффект блокирован добавлением субтерапевтической дозы дроперидола – 1,25 мг (15 мкг/кг – стандартная для всех групп).
Во 2-ой группе (Ак+П) – 85 человек, учитывая известный синергизм при достижении центральной аналгезии [13], к 10 мг акупана добавлялся перфалган (парацетамол) в субтерапевтической дозе 100 мг (1,25 мг/кг).
Пациентам 3-й группы (Тр) – 53 человека – упреждающая аналгезия и седация обеспечивалась внутривенным введением наркотического анальгетика трамадола, обладающего свойствами агониста опиатных рецепторов, в дозе 100 мг в сочетании с дроперидолом 1,25 мг (при исходном АДс> 140 мм рт.ст.).
Во всех 3-х группах указанные препараты вводились внутривенно медленно за 10 минут до начала операции, для обеспечения аналгоседации перед проведением субтеноновной блокады 2 % раствором лидокаина.
При недостаточной анальгезии во время операции дополнительно вводился фентанил фракционно в дозе 50–100 мкг. Критериями назначения фентанила было развитие ОКС, жалобы пациента на боль, реже – нарастающая тахикардия. При выраженной тревожности на II-м этапе вводился элзепам в дозе 0,5 мгс последующим учётом потребности в добавочной аналгезии и седации в каждой группе. Критериями назначения элзепама было психомоторное возбуждение, явное напряжение пациента с повышением АД и жалобы на страх. Повышение АД купировалось дополнительным введением дроперидола – 2,5 мг.
Мониторировались показатели гемодинамики (среднее артериальное давление – САД, частота сердечных сокращений – ЧСС); оксигенации (насыщение Hb кислородом – Sat O2). Этапы исследования: I – исходные данные при поступлении в операционную; II – показатели после внутривенного введения анальгетиков и седативных препаратов в начале операции (при выполнении блокады); III – сразу после окончания операции. Анализировалась частота интраоперационных критических инцидентов (окулокардиального синдрома – ОКС; других нарушений ритма сердца; артериальной гипертензии; артериальной гипотензии; болезненности по ходу вены при введении препаратов). При поступлении в операционную и в конце операции оценивался уровень седации по шкале RASS, адаптированной к нашим условиям. По 5-балльной вербальной шкале оценки боли (Frank A. J. М., Moll J. М. H., Hort J. F., 1982) у пациентов оценивались болевые ощущения, связанные с операцией.
Обработка данных проводилась с помощью программы MS Excel. Для определения достоверности различий между группами оценивался характер распределения в выборке, использовался параметрический критерий Стьюдента или непараметрический критерий x2 (xи-квадрат), вычислялось значение вероятности совпадения.
Результаты и обсуждение
Показатели гемодинамики (табл. 2) в 1-й и 2-ой группах в момент начала операции были стабильными, с незначительной тенденцией к увеличению ЧСС на II-м этапе. К концу операции частота пульса в 1-й группе достоверно увеличилась на 13 %, что может быть связано с реализацией симпатомиметического эффекта акупана, хотя это и не подтверждается показателями 2-й группы. В 3-й группе, где внутривенная анальгезия обеспечивалась трамадолом, на II-м этапе зафиксировано достоверное повышение САД на 4,6 %, по сравнению с I-м этапом, к концу операции САД снизилось до исходных цифр. Показатели ЧСС в этой группе были стабильными с незначительной тенденцией к урежению ритма сердца к концу операции. Подобные изменения гемодинамики вероятнее объясняются пролонгированным «стрессом ожидания», чем реакцией на острую боль.
Таблица 2
Динамика показателей гемодинамики в исследуемых группах
|
Исследуемые показатели |
САД, мм рт. ст. |
ЧСС, мин-1 |
||||
|
I этап |
II этап |
III этап |
I этап |
II этап |
III этап |
|
|
1-я группа (Ак+К) |
109,4±11,7 |
105,8±9,9 |
102,6±11,8 |
72,7±6,2 |
75,8±6,4 |
82,6±8,9 ΔΔΔ |
|
2-я группа (Ак+П) |
107,2±7,4 |
109,7±11,2 |
103,1±11,4 |
75,7±5,8 |
76,3±9,3 |
73,3±8,9** |
|
3-я группа (Тр) |
107,6±7,0 |
112,4 ±12,5 Δ |
106,1±10,6 ΔΔ |
73,2±6,1 |
73,8±10,7 |
71,7±7,4* |
|
Т-Тест |
*-p1-3<0,05; **- p1-2<0,05; ?- pI-II<0,05; ΔΔ - pII-III<0,05; ΔΔΔ- p I-III<0,05 |
|||||
Достоверных различий в показателях оксигенации между группами и на разных этапах не было, а зафиксированная тенденция к снижению SatO2 в группе с трамадолом на II-м и III-м этапах не превышала критических значений и объяснялась известным эффектом угнетения дыхательного центра на фоне введения опиатов (табл. 3).
Таблица 3
Динамика показателей газообмена в исследуемых группах
|
Исследуемые показатели |
SatO2, % |
||
|
I этап |
II этап |
III этап |
|
|
1-я группа (Ак+К) |
96,3±1,1 |
96,5±1,6 |
96,9±1,6 |
|
2-я группа (Ак+П) |
96,3±1,0 |
96,4±1,6 |
97,0±1,4 |
|
3-я группа (Тр) |
96,2±1,6 |
95,2±3,7 |
94,9±4,3 |
В 1-ой и 2-ой группах частота и спектр критических инцидентов практически не различались, преобладали реакции, характерные для вторичного симпатомиметического эффекта акупана – артериальная гипертензия, тахикардия, аритмии. Аритмии в большей части наблюдений характеризовались суправентрикулярной, реже – желудочковой экстрасистолией, носившей транзиторный характер и не требовавшей медикаментозного вмешательства. В одном случае у пациентки, скрывшей во время предоперационного осмотра наличие пароксизмальных нарушений ритма, развился пароксизм тахиформы мерцательной аритмии, купированный в течение 2-х часов парентеральным введением 600 мг амиодарона (кордарона). Операция успешно проведена на следующий день на фоне упреждающей анальгезии трамадолом. Выписана через 2 суток в удовлетворительном состоянии.
Частота критических инцидентов в исследуемых группах представлена на рис. 1 и 2.
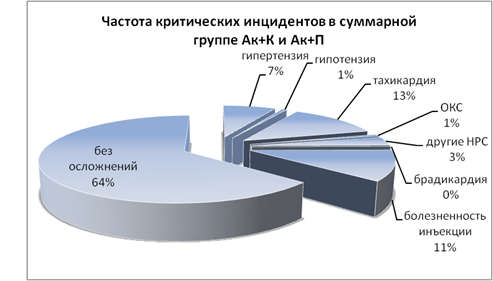
Рис. 1. Частота критических инцидентов в 1-й и 2-й группах
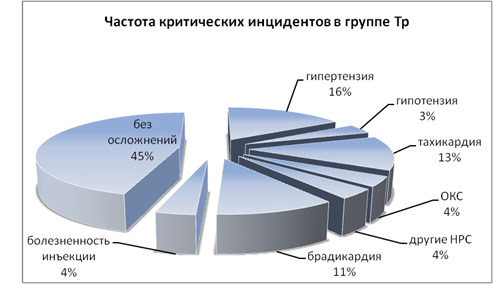
Рис. 2. Частота критических инцидентов в 3-й группе
Анализ частоты критических инцидентов в группе трамадола продемонстрировал характерные для опиатов ваготонические эффекты: брадикардию (11 %), практически не встречавшуюся в группах акупана (p<0,05); ОКС (4 %) (p<0,05), редкую желудочковую экстрасистолию, не потребовавшую медикаментозной коррекции (p>0,05). Реже, чем в группе акупана (11 %), отмечалась болезненность по ходу вены при введении трамадола (4 %). Обращает внимание достоверно более высокая частота эпизодов артериальной гипертензии (p<0,05) в группе трамадола (16 %), по сравнению с группами акупана (7 %), что, в сочетании с относительно невысокими показателями встречаемости тахикардии (13 % в 1-ой и 2-ой группах и 13 % в 3-ей группе, p>0,05), также может свидетельствовать о пролонгированном «стрессе ожидания». Артериальная гипотензия недостоверно чаще (p>0,05) фиксировалась в 3-й группе (3 %), чем в группе с введением акупана (1 %).
При анализе субъективного ощущения боли достоверных различий не получено. Так, жалобы на неприятные ощущения в процессе операции предъявили 7 человек (5,3 %) из 1-й и 2-ой групп и 3 пациента (5,6 %) из 3-ей группы (p>0,05). Боль оценивалась как слабая или (однократно в 1-ой группе) как терпимая (табл. 4). Это подтверждалось низкой потребностью дополнительного введения фентанила – 3 (2,3 %) в группах акупана и 4 (7,5 %) в группе трамадола (p>0,05). В основном фентанил вводился для купирования ОКС, и в большинстве случаев операция не сопровождалась типичными болевыми ощущениями у пациентов.
Таблица 4
Оценка пациентом боли по 5-балльной вербальной шкале
|
Уровень боли |
Количество человек (%) |
x2 |
|
|
Акупан (1+2-я группы) |
Трамадол (3-я группа) |
||
|
2 |
1 (1,1) |
0 |
0,27 |
|
1 |
6 (7,1) |
3 (5,8) |
0,72 |
Оценка степени седации демонстрирует отсутствие достоверных различий между группами с применением акупана или трамадола (табл. 5). Однако дополнительное введение элзепама потребовалось только 1(1,2 %) пациенту в группе акупана, тогда как в группе трамадола таких пациентов было 17(20,0 %) (p<0,05).
Таблица 5
Уровень седации в течение операции по шкале RASS при обезболивании акупаном в сочетании с парацетамолом (2-я группа) и трамадолом (3-я группа)
|
Уровень седации по шкале RASS |
Оценка седации при поступлении в операционную |
x2 |
Оценка седации в конце операции |
x2 |
||
|
Количество человек (%) |
Количество человек (%) |
|||||
|
Акупан |
Трамадол |
Акупан |
Трамадол |
|||
|
2 |
0 |
1 (1,9) |
0,06 |
0 |
0 |
- |
|
1 |
12(14,1) |
13 (24,5) |
1,10 |
5 (5,9) |
3 (5,7) |
0,10 |
|
0 |
70 (82,4) |
38 (71,7) |
1,64 |
60 (70,5) |
30 (56,6) |
2,23 |
|
-1 |
3 (3,5) |
1 (1,9) |
0,20 |
19 (22,4) |
16 (30,2) |
0,69 |
|
-2 |
0 |
0 |
- |
1 (1,2) |
4 (7,5) |
2,19 |
Признаки повышенной тревожности – двигательная активность, напряжение, повышение АД на II-м этапе, потребовавшие дополнительного введения элзепама, были не характерны для 1-ой и 2-ой групп. По окончании операции пациенты адекватно реагировали на окружающую обстановку, не были сонными, при этом уровень тревожности у них был явно ниже исходного. Из этого можно сделать вывод, что сочетание акупана с субтерапевтическими дозами дроперидола оказывает выраженный анксиолитический и атарактический эффект без значимого гипнотического компонента.
Выводы
Анальгетический эффект нефопама в сочетании с НПВС сравним с эффектом трамадола. Введение дроперидола нивелирует симпатомиметические эффекты нефопама. Сочетание субтерапевтических доз нефопама и дроперидола во время операции у пожилых пациентов обеспечивает достаточный анксиолитический эффект без значимого гипнотического и амнестического действия.
У пожилых пациентов в офтальмохирургической практике в качестве упреждающей анальгезии, достаточной для обезболивания дозой нефопама, является 10 мг (1/2 рекомендуемой дозировки). Уменьшенные дозировки нефопама, перфалгана и дроперидола, вероятно, уменьшают риск развития известных побочных эффектов этих препаратов.
Сочетание трамадола с малыми дозами дроперидола оказывает недостаточный седативный эффект и в 20 % случаев требует дополнительного введения бензодиазепинов, что является нежелательным, учитывая пожилой возраст пациентов и риск развития когнитивных нарушений.
Применение предложенного нами сочетания нефопама, перфалгана и дроперидола обеспечивает большую стабильность гемодинамики и более успешно предупреждает развитие окулокардиального синдрома. Пароксизмальные нарушения ритма в анамнезе следует считать противопоказанием для назначения нефопама.



