Бурное развитие исследований в области изучения биологии стволовых клеток человека связано с растущими потребностями регенеративной медицины. Однако региональные стволовые клетки человека, которые обеспечивают процессы регенерации тканей в случае повреждения, представлены в органах очень небольшой фракцией, что затрудняет их исследование in vivo. С другой стороны, взрослые стволовые клетки пресноводных планарий, называемые необластами, составляют до 30% от общего количества клеток планарии [23] и быстро формируют на раневой поверхности регенерационную бластему. Более того, консервативная часть генома стволовых клеток человека, ответственная за пролиферацию и дифференцировку, высоко гомологична (до 90%) соответствующим генам планарий [25; 35]. К достоинствам необластов относится и тот факт, что обнаружены виды планарий, которые по аналогии с высшими животными не способны восстанавливать утраченные части тела, в частности Dendrocoelum lacteum. Однако нокдаун единственного гена (Dlac-β-катенин-1) в системе Wnt-сигнализации воссоздаёт способность к регенерации, несвойственную этому виду организмов [30]. Предлагается использовать уникальные репарационные возможности планарий и для исследования механизмов старения [33]. Критическим моментом современной регенеративной медицины является непредсказуемая малигнизация стволовых клеток, отсутствующая у необластов планарии. Выяснение генетических причин этой особенности необластов может стать ключом к решению вопроса спонтанной малигнизация у стволовых клеток млекопитающих и человека. В последнее десятилетие планарии стали рассматриваться как перспективная модель для регенеративной медицины, и в частности клеточной биологии стволовых клеток. Создана база данных генома планарий [http://genome.wustl.edu/genomes] и определено около 30 геномных участков, имеющих значительное сходство с генами важнейших нейродегенеративных заболеваний человека [21]. Тот факт, что многие из генов, лежащих в основе процессов регенерации, эволюционно консервативны [25; 36], позволяет рассматривать планарий в качестве адекватной модели для изучения регенерации тканей и биологии стволовых клеток у высших животных и человека [23].
Однако обманчивая простота организации планарий и неприхотливость к условиям содержания стали причиной плохой воспроизводимости экспериментов, на что неоднократно указывал ряд авторов [3; 8; 9; 18; 28; 29; 31]. Ниже будет показано, что регламентация условий культивирования и стандартизация параметров экспериментов позволяют не только решить проблему плохой воспроизводимости экспериментов, но и значительно уменьшают ошибку измерения морфометрических параметров [5].
Результаты и обсуждение
Культивирование планарий по-разному осуществляется в разных лабораториях [9; 10; 32; 36]. Учитывая высокую чувствительность процессов регенерации планарий к широкому кругу биологически активных веществ [6; 11-13; 16; 24; 26], особое внимание следует обратить на качество воды, используемой для культивирования планарий и проведения экспериментов. Наш многолетний опыт показал, что культивировать пресноводных планарий удобно в пластиковых контейнерах, предназначенных для хранения пищевых продуктов, используя в качестве культуральной среды питьевую воду с рН 7,0-7,5 и жёсткостью порядка 1,5-2,0 мг-экв/л.
При плотности посадки планарий, обычно не превышающей 200 шт/литр, удаление остатков корма и смену 80-90% воды желательно проводить через 2-3 часа после каждого кормления.
Освещённость и длительность светового дня определяют суточные и годовые ритмы у самых различных организмов через метаболизм мелатонина [14]. У пресноводных планарий обнаружены ферменты синтеза мелатонина, аналогичные ферментам шишковидной железы и сетчатки млекопитающих. Активность этих ферментов и уровень эндогенного мелатонина проявляют выраженный циркадный ритм [22]. Нами показано, что мелатонин не только определяет циркадный цикл, но и оказывает воздействие на процесс регенерации планарий [1; 2]. Этот факт отмечался и другими исследователями [19]. Это означает, что стандартизация освещённости и продолжительности светового дня у планарий требуется уже на этапе подготовки к экспериментам. Нами экспериментально подобрана оптимальная освещённость половины площади дна сосудов с планариями на уровне 50-70 люкс, а другой половины - около 5-10 люкс. Условия различной освещённости позволяют планариям индивидуально подбирать освещённость в течение светового дня, длительность которого составляла 12 часов в течение всего года. В этих условиях в качестве биологического фильтра, очищающего воду от продуктов жизнедеятельности планарий и поддерживающего биологическое равновесие после удаления остатков корма и смены воды, рекомендуется использовать несколько веточек роголистника Ceratophyllum L., 1753.
Кормление планарий значительно влияет на процесс регенерации. Известно, что многие вещества легко вводятся в организм планарий вместе с пищей [10; 17]. Нами показано, что процесс регенерации подвержен влиянию многих веществ, в частности ряда экзогенных нейропептидов [11], серотонина, мелатонина, а также ретиноевой кислоты [1; 2; 34]. На основании этих результатов следует ожидать, что мотыль, ранее используемый и нами, может влиять на состояние необластов, модулируя процесс регенерации планарий. Очевидно, что мотыль, добытый в разные сезоны и в разных водоёмах, может содержать разное количество многих биологически активных веществ. Отметим, что нами выявлена чувствительность процесса регенерации к действию канальных белков-ионофоров [6] и наночастиц серебра [24], что накладывает дополнительные условия к качеству воды в водоёмах, в которых добывался мотыль. Стандартизация кормления, в наших условиях, заключается в использовании свежей печени новорожденных линейных крыс.
Влияние температуры на процесс регенерации планарий исследовалось в диапазоне от 15 до 35 °С (рис. 1). Наибольшее значение площади проекции, регенерирующей планарии G. tigrina через 72 часа после операции, было обнаружено при 26 °С [9].
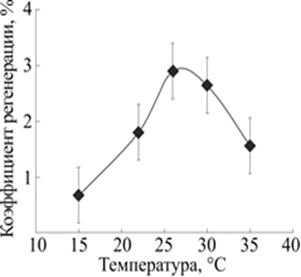
Рис. 1. Температурная зависимость коэффициента регенерации через 72 часа после декапитации
По горизонтали: температура, °С. По вертикали: коэффициент регенерации![]() , где s – площадь проекции бластемы,
, где s – площадь проекции бластемы, ![]() – площадь проекции регенерирующего фрагмента
– площадь проекции регенерирующего фрагмента
Отметим, что незначительные колебания температуры вблизи максимума не вызывают достоверных изменений регистрируемых параметров. Более того, величина коэффициента регенерации, полученная через 72 часа после декапитации при 26 °С, в 2 раза больше величины, полученной при комнатной температуре порядка 21 °С.
Суточные колебания температуры в лабораторном помещении в некоторые дни могли достигать 6-8 градусов, а разность температур между сосудами с планариями, расположенными в разных местах одной комнаты, зависит от конвекционных потоков, формы сосуда и может превышать 2-3 градуса (рис. 2).
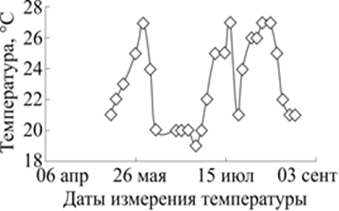
Рис. 2. Колебания температуры в лабораторном помещении в летний период 2000 года
По горизонтали: даты. По вертикали: температура на лабораторном столе в полдень
Таким образом, естественные колебания температуры могут привести к серьезным различиям в темпах регенерации у планарий из разных экспериментальных групп. Очевидно, что минимизация ошибок, связанных с влиянием годовых и суточных колебаний температуры, достигается термостатированием всего помещения с планариями. Отметим, что освещённость и длительность светового дня также должны поддерживаться как у экспериментальных, так и у контрольных планарий.
Кинетики процесса регенерации планарий исследовались нами при разных температурах среды (рис. 3).
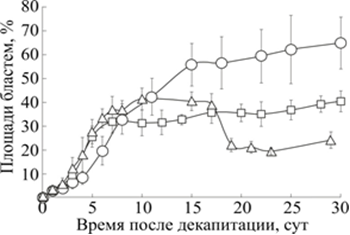
Рис. 3. Кинетики площади проекции бластемы (s) декапитированных планарий G.tigrina
при 17, 20 и 28 °С
По вертикали: площадь бластемы в процентах от площади головы интактной планарии до декапитации. По горизонтали: сутки после декапитации.
0 – площадь бластемы планарий при 17 °С;
□ – площадь бластемы планарий при 20 °С;
Δ – площадь бластемы планарий при 28 °С
Из рис. 3 следует, что миграция необластов в бластему в течение первой недели при 17 °С происходило медленнее, чем при 20 и 28 °С. Проведённые измерения потребовали пересмотра устоявшегося представления о «росте бластемы в процессе регенерации». Эксперимент показал, что после первой недели регенерации при 20 °С миграция необластов в бластему замедлялась, а при 28 °С после 15-20-го дня количество необластов в бластеме не только стабилизировалось, но и начало уменьшаться. Это означает, что в процессе регенерации организм планарии стремится восстановить пропорции тела, в частности отношение площади бластемы s к площади остального тела S, что подтверждает наши ранние результаты [7].
При температуре 28 °С после 15-20-го дня регенерации площадь бластемы уменьшается вслед за уменьшающейся площадью регенерирующего фрагмента. Недавно показано, что уменьшение размеров планарии сопровождается не увеличением гибели дифференцированных клеток, а уменьшением количества пролиферирующих стволовых клеток [20].
Энергетические оценки процесса жизнедеятельности, в частности регенерации, можно сделать по оценке изменения биомассы голодающих планарий. Отметим, что скорость уменьшения размеров регенерирующих планарий практически не отличалась от интактных. Это означает, что энергетические затраты в процессе регенерации не превышают затраты при нормальной жизнедеятельности. Ниже представлены зависимости общей площади регенерирующей планарии (S+s) от времени после декапитации при разных температурах (рис. 4).
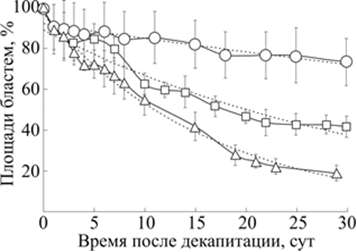
Рис. 4. Кинетики общей площади (S+s) голодных декапитированных планарий G. tigrina
при 17, 20 и 28 °С
По вертикали: общая площадь в процентах от площади планарии после декапитации. По горизонтали: сутки после декапитации.
0 – общая площадь планарий при 17 °С, y=0.9257e-0.008x, R² = 0.8874;
□ – общая площадь планарий при 20 °С, y=0.8952e-0.029x, R² = 0.9318;
Δ – общая площадь планарий при 28 °С, y=0.9777e-0.061x, R² = 0.986
Полученные кривые позволяют заключить, что общая площадь (S+s) планарии экспоненциально падает в процессе регенерации. В простейшем предположении о пропорциональности биомассы регенерирующей планарии (M) регистрируемой площади проекции (S+s) можно заключить, что характерные времена сжигания биомассы существенно зависели от температуры. Действительно, при 17 °С биомасса уменьшалась в е раз за 125 суток (М=Моe-0.008t), при 20 °С - за 34 дня (М=Моe-0.029t), а при 28 °С - всего за 16 суток (М=Моe-0.061t). Экспоненциальная зависимость биомассы от времени регенерации с голоданием свидетельствует о постоянстве скорости сжигания относительной биомассы: ![]() и постоянстве количества пролиферирующих стволовых клеток [20] .
и постоянстве количества пролиферирующих стволовых клеток [20] .
Периодичность кормления планарии G. tigrina зависит от температуры среды (рис. 5). Кривая построена в предположении пропорциональности постоянных времени уменьшения биомассы при разных температурах и периодичности кормления, поддерживающего постоянство биомассы планарии. Еженедельная периодичность кормления при 20 °С была установлена исходя из многолетнего опыта содержания планарий при комнатной температуре.

Рис. 5. Зависимость периодичности кормления планарии G. tigrina от температуры среды.
По горизонтали: температура в градусах Цельсия, °С.
По вертикали: периодичность кормления, сутки-1
Значения периодичности кормления, расположенные под балансной кривой, будут способствовать росту планарий, а значения над кривой - уменьшению их размеров. Таким образом, если периодичность кормления при 20 °С составляет 7 дней, то при 17 °С составит более двух недель, а при 22 °С < t <26 °С составит 3 дня, а при температуре выше 28 °С - всего 2 дня. Поскольку в экспериментах традиционно используются голодные планарии, то в зависимости от температуры культивирования устанавливается время готовности к эксперименту: при 28 °С - 2 дня, при 17 °С - более 2-х недель.
Если существует потребность увеличить размер или численность популяции планарий, то частоту кормления можно увеличить. Очевидно, что верхний предел частоты кормления определяется плотностью посадки планарий и периодичностью смены воды.
Зависимость величины коэффициента регенерации от фазы процесса регенерации, а не от времени после декапитации легко проявляется при изменении температуры (рис. 6). Нами было показано, что процесс регенерации при 26 °С протекает активнее, чем при более низких температурах, и, следовательно, та фаза регенерации, которая при 21 °С наступала через 72 часа после операции, при 26 °С наступит уже через 48 часов.
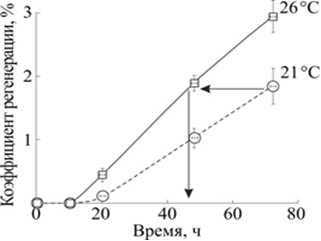
Рис. 6. Изменение коэффициента регенерации планарий в течение 72 часов после декапитации при температурах 21 и 26 °С
По горизонтали: время после декапитации, час. По вертикали: коэффициент регенерации ![]() , где
, где ![]() – площадь проекции бластемы,
– площадь проекции бластемы, ![]() – площадь проекции регенерирующего фрагмента
– площадь проекции регенерирующего фрагмента
Из рис. 6 следует, что значение коэффициента регенерации, достигаемое при 20 °С через 72 часа, при температуре 26 °С достигается уже через 48 часов.
Ранее нами было показано, что при температуре 20-21 °С слабое комбинированное магнитное поле, настроенное в режиме параметрического резонанса на ионы кальция через 72 часа после декапитации, приводило к стимуляции процесса регенерации [8], однако при температуре 26 °С стимулирующий эффект регистрировался через 48 часов, а через 72 часа эффект слабого КМП практически не отличался от фона [9]. Это означает, что отсутствие биологического эффекта при произвольном выборе начала и длительности экспозиции в слабом КМП не свидетельствует об отсутствии чувствительности биологического объекта к конкретному воздействию. Причины плохой воспроизводимости результатов со слабыми электромагнитными полями могут скрываться в отсутствии должного внимания как к температурным, так и к временным параметрам конкретного эксперимента.
Яркость и однородность освещения поля зрения микроскопа влияют на качество получаемого изображения планарии и на ошибку измерения длин и площадей. Регистрация изображения планарии с целью минимизации ошибки компьютерной программы должна осуществляться в поле однородной освещённости. Яркость освещения подбирается по максимальному количеству видимых деталей и оттенков серого на изображении планарии. Оператору необходимо тщательно устанавливать яркость и однородность освещения непосредственно перед каждым экспериментом.
Регистрация площади проекции и длины тела планарии является ключевым моментом эксперимента и требует стандартизации положения планарии в горизонтальной плоскости в поле зрения микроскопа. Условиям стандартизации удовлетворяет равномерное горизонтальное движение планарии, когда особь максимально распластана и движется посредством ресничек. Для определения этого момента необходима определённая квалификация оператора, т.к. регистрируемая длина тела и площадь проекции планарии могут быть меньше реальных на 10-20%. Это означает, что из нескольких изображений, полученных на одном и том же регенерирующем фрагменте, следует отбирать изображение с максимальными значениями длины тела и площади проекции планарии.
Отбор однородных особей играет большую роль в обеспечении статистической гомогенности группы. В идеале следует получить качественное изображение и провести замеры длины, ширины и площади проекции каждой планарии, а затем отобрать 20-30 особей с близкими морфометрическими параметрами. На практике, после накопления некоторого опыта, удовлетворительного результата можно добиться при оценке размеров планарии в поле зрения микроскопа. При этом следует учитывать, что отношение длин бластемы и тела регенерирующей планарии восстанавливается при комнатной температуре через 20 дней, а отношение площадей бластемы и тела - только к 30-му дню [4]. При 26-28 °С все пропорции тела планарии восстанавливаются уже через 15 дней (рис. 3). Это означает, что конкретная особь может использоваться в очередном эксперименте уже через 2 недели после декапитации или акта бесполого размножения.
Ампутация определённых фрагментов планарии осуществляется экспериментатором, и вклад этого процесса в погрешность эксперимента определяется только его опытом. Очевидно, что ошибку при рассечении планарии и длительность операции по ампутации определённых частей тела желательно минимизировать, что достигается только опытом оператора. Ограничения на время проведения операции определяются, в частности, тем фактом, что эффект действия слабого магнитного поля зависит от времени между операцией и началом экспозиции [8; 9]. Очевидно, что максимальная ошибка, связанная с продолжительностью операции, возникает при физических или химических воздействиях, задаваемых непосредственно или через небольшой промежуток времени после ампутации.
Оценка вклада погрешностей аппаратуры, компьютерных программ и оператора в ошибку эксперимента может быть проведена на основании измерений, представленных в таблице.
Все измерения были выполнены при оптимальной освещенности поля зрения. В первой серии одно изображение одной планарии замерялось 30 раз, во второй серии - 30 изображений одной планарии замерялось по одному разу, а в третьей серии измерялось по одному изображению по одному разу, но уже у 30 разных планарий. Оценка стандартного отклонения проводилась в программе Microsoft Office Excel 2010.
Величины стандартного отклонения от среднего значения площади и длины планарии при разных режимах измерения
|
Серия измерения |
Стандартное отклонение, δ |
|
|
площади δS, % |
длины δL, % |
|
|
1 |
0,9 |
0,13 |
|
2 |
3,4 |
3,4 |
|
3 |
15,4 |
11,6 |
Из таблицы следует, что ошибки измерений, выполненных на 30 изображениях одной планарии (серия 2) в несколько раз превосходят ошибки, возникающие при 30-кратном анализе единственного изображения (серия 1). Это означает, что определяемая оператором распластанность единственной планарии вносит существенный вклад в ошибку измерения морфометрических параметров (серия 2). Ответственность оператора за точность измерения существенно вырастает при проведении измерений на 30 различных планариях (серия 3). Ошибка при этом складывается из морфометрических различий 30 отобранных особей, из ошибки оператора при хирургическом удаления фрагментов тела планарии, а также всех ошибок, возникающих в серии 2. Разница между ошибками длин и площадей, полученными в сериях 2 и 3, определяется только человеческим фактором и, следовательно, может быть значительно уменьшена в процессе обучения оператора.
Заключение. Влияние температуры, освещённости и продолжительности светового дня не учитывалось в наших работах до 2012 года и, к сожалению, не учитывается в большинстве современных исследований. Плохая воспроизводимость экспериментов с планариями и слабыми магнитными полями отмечалась многими экспериментаторами, однако конструктивных мер предложено не было [15; 18; 27-29; 31]. Нами экспериментально показано, что регламентация таких параметров культивирования планарий, как состав и температура воды, освещённость и длительность светового дня, состав корма и периодичность питания, позволяют добиться высокой воспроизводимости экспериментов с регенерирующими планариями.
Нами показано, что максимальный вклад в ошибку эксперимента вносят морфометрические различия отобранных особей и ошибки экспериментатора при ампутации различных фрагментов тела планарии. Это означает, что регламентация условий эксперимента и повышение квалификации экспериментатора позволяют существенно уменьшить ошибку измерения морфометрических показателей.
Работа проведена при поддержке гранта по Госзаданию Министерства образования и науки РФ № 2912. и гранта РФФИ 15-29-01135.



