Известное допущение о возможности существования в прошлом или настоящем жизни за пределами нашей планеты основано на новых представлениях об устойчивости микроорганизмов к воздействию экстремальных физико-химических факторов, в том числе космических факторов. Планетные исследования, изучение природных экстремальных биотопов Земли, моделирование потенциальных внеземных условий обитания позволяют оценивать возможность существования форм жизни земного типа на различных объектах Солнечной системы, выбирать перспективные регионы для астробиологического поиска, разрабатывать и совершенствовать методы обнаружения жизни. Устойчивость микроорганизмов in situ в природных местообитаниях, в основе которой лежат адаптационные механизмы клетки, популяций и целых микробных сообществ, запускаемые первичными реакциями на стресс, имеет эволюционный характер развития. Эти процессы должны быть исследованы применительно к различным сочетаниям воздействия факторов, формирующих ту или иную среду. Опираясь на данные по высокой жизнеспособности микроорганизмов в природной среде, и особенно в экстремальных местообитаниях, астробиология ставит задачу расширенного переосмысливания механизмов реакции на стресс и последующей адаптации клеток с экстраполяцией знаний на космическую и инопланетную среду и учетом эволюционных планетарных процессов.
При анализе космической или инопланетной среды как потенциальной среды обитания одним из ключевых факторов воздействия является ионизирующая радиация. Специфика воздействия этого фактора, с точки зрения астробиологии, заключается не только в широком диапазоне варьирования показателей применительно к различным объектам Солнечной системы, но и в аккумуляции дозы для биообъектов. Пределы устойчивости земной формы жизни к воздействию ионизирующих излучений достоверно не определены, а многие эксперименты по исследованию влияния радиации на биообъекты не учитывают совокупного эффекта факторов среды, модифицирующих воздействие ионизирующих излучений [4, 9]. Это требует дальнейших исследований и моделирования в условиях, наиболее близких к параметрам целевых астробиологических объектов.
В настоящей работе изучена реакционная способность экзометаболитов и активность ферментов окислительного стресса на примере каталазы после облучения гамма-излучением бактерий Kocuria rosea SN_T60 и Arthrobacter polychromogenes SN_T61 в условиях, моделирующих основные физические параметры поверхностного слоя реголита Марса (температура -50 °С, давление 1 торр).
Материалы и методы
Объектом исследования являлись штаммы Kocuria rosea SN_T60 и Arthrobacter plychromogenes SN_T61, выделенные из описанного нами ранее образца серозема из пустыни Негев (Израиль) [3] при посеве на разбавленную среду TSA (1:2) (Difco, США). Идентификация штаммов была проведена методом MALDI-TOF масс-спектрометрии на MALDI-TOF масс-спектрометре Microflex (Bruker Daltonics, Германия). Анализ полученных спектров проводили с помощью программы MALDI Biotyper 3.0.
Для проведения облучения отбирали биомассу в стационарной фазе роста, суспендировали в стерильной воде, вносили в стерильный (трижды автоклавированный в течение 20 минут при 121°С) монтмориллонит и тщательно перемешивали, затем просушивали в термостате в течение 3 суток при 28°С.
Навески монтмориллонита с внесенными в него клетками помещали в описанную нами климатическую камеру [8], позволяющую поддерживать давление 1 торр и температуру – 50 °С в течение всего времени облучения. Облучение проводили на гамма-установке К-120000 с источниками 60Со при интенсивности излучения 0.5 кГр/ч и 3 кГр/ч. Помимо исходной культуры исследовали контрольный вариант при воздействии низкого давления и температуры без проведения облучения.
Определение численности культивируемых бактерий проводили методом посева на плотную глюкозо-пептоно-дрожжевую питательную среду (ГПД): пептон – 2 г/л; глюкоза – 1 г/л; дрожжевой экстракт – 1 г/л; гидролизат казеина – 1 г/л; СаСО3 – 1 г/л, агар-агар - 20 г/л. Перед посевом проводили десорбцию микроорганизмов на вортексе Heidolph Multi Reax в течение 30 минут при 2000 об./мин. Суспензии образцов в различных разведениях рассевали в трехкратной повторности с одновременным контролем стерильности среды и контролем присутствия воздушной микрофлоры. Культивирование проводили при комнатной температуре.
Реакционную способность экзометаболитов (РС, окислительную − ОА и антиокислительную − АОА активность) определяли методом химических моделей [2]. В качестве модели использовали 0,04%-ный раствор 3,4−диоксифенилаланина (ДОФА) в дистиллированной воде. ОА и АОА определяли соответственно по повышению или понижению скорости реакции окисления ДОФА в контроле (чистая жидкая среда ГПД) и при добавлении культуральной жидкости бактерий, содержащей нативные экзометаболиты. Ускорение или торможение реакции окисления ДОФА культуральной жидкостью по сравнению с чистой средой определялось тангенсом угла наклона кривой нарастания оптической плотности во времени при постоянной температуре 45 °С на приборе «Аквакон-4» [2]. Культуральную жидкость отделяли от клеток с помощью фильтрования через шприцевые мембранные фильтры с диаметром пор 0.22 мкм (Millipore, США). Измерения проводили в трехкратной повторности.
Активность каталазы в культуральной жидкости определяли газометрически, согласно методике, описанной ранее [1]. Измерения проводили в трехкратной повторности.
Результаты и обсуждение
Оба штамма проявили высокую устойчивость к совокупному воздействию экстремальных факторов. После облучения в модельных условиях Марса число колониеобразующих единиц (КОЕ) K. rosea и A. polychromogenes возросло в 1.7–2.6 раз. В контрольном эксперименте после воздействия низкой температуры и давления (без облучения) число КОЕ K. rosea увеличилось в 6.5 раз (рис. 1, 2). Таким образом, увеличение численности культивируемых клеток явилось ответом на воздействие низкой температуры, и, возможно, низкого давления, но не гамма-излучения. Высушивание иммобилизованной в минерале культуры в вакууме способствовало дополнительной иммобилизации клеток, что могло привести к изменению их физиологического состояния и метаболизма. Известно, что замораживание-оттаивание может способствовать активизации пролиферации клеток [10]. Согласно литературным данным, доза гамма-излучения 2 кГр приводила к гибели 90 % клеток популяции K. rosea [6]. Однако в нашем эксперименте доза 1 кГр в вакууме при низкой температуре не подавляла численность репродуцирующих клеток. Это может быть объяснено различно: а) снижением радиационных повреждений клеток вследствие проведения облучения при отрицательной температуре [4]; б) гетерогенностью бактериальных популяций [6] и компенсацией ингибирующего воздействия на компоненты популяции ионизирующего излучения за счет активизации других компонентов вследствие воздействия температурных флуктуаций и вакуума, проявившегося в необлученном контроле; в) высокой устойчивостью к множественному стрессу штаммов, адаптированных к экстремально ксерофитным местообитаниям [7]. Воздействие целого ряда экстремальных физических факторов проявляется через окислительный стресс, что позволяет микроорганизмам активизировать вполне универсальные механизмы отклика с последующей адаптацией в стабильно неблагоприятных условиях [5].
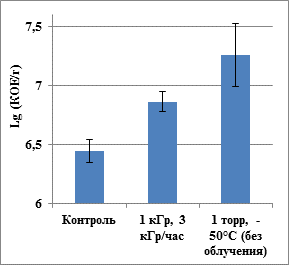
Рис. 1. Влияние гамма-излучения (1 кГр), низкой температуры (-50°С) и низкого давления (1 торр) на численность культивируемых клеток K. rosea SN_T60. Значение погрешности соответствует стандартному отклонению
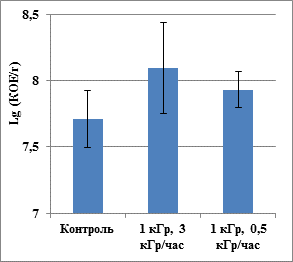
Рис. 2. Влияние гамма-излучения (1 кГр), низкой температуры (-50°С) и низкого давления (1 торр) на численность культивируемых клеток A. polychromogenes SN_T61. Значение погрешности соответствует стандартному отклонению
Экстремальное воздействие исследованной совокупности физических факторов значительно повлияло на реакционную способность экзометаболитов бактериальных штаммов. У контрольного штамма K. rosea в первые 6 суток культивирования РС лежит в области антиокислительной активности, достигая наибольших значений АОА к 6 ч и 72 ч роста, затем переходит в область окислительной активности с максимумом ОА на 10 сутки. После этого происходит плавное снижение ОА (рис. 3). У штамма K. rosea SN_T60 после экспонирования в режиме условий Марса РС резко изменяется в тех же точках (6 ч, 30 ч, 72 ч, 10 суток), что и у контрольного варианта. Однако в период 6–48 ч роста экзометаболиты обладают до 27 % более высокой окислительной активностью. В дальнейшем оба экспонированных варианта (облученный и необлученный) проявляют значительно более высокую АОА, чем контроль: в период с 3 по 25 сутки АОА превышает уровень контроля на 40–90 %. При этом активность антиоксидантов выше при вакуумировании при отрицательной температуре.
Еще более значительно проявилось повышение АОА после облучения у штамма A. polychromogenes SN_T61. За весь период измерений РС экзометаболитов контрольного штамма находилась в окислительной области, РС экспонированных вариантов штамма – в антиокислительной (рис. 4). С 10 ч. до 25 суток роста АОА в облученном варианте на 75–150 % превышала уровень контроля. Принципиальных расхождений между вариантами, получившими равные дозы в режимах различной интенсивности облучения, не отмечено.
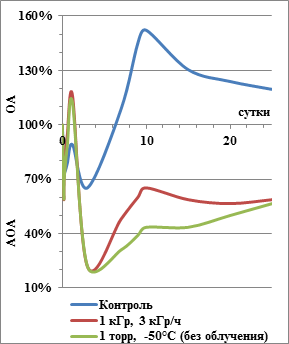
Рис. 3. Изменение РС экзометаболитов K. rosea SN_T60 после воздействия гамма-излучения, низкого давления и низкой температуры. ОА – область окислительной активности; АОА – область антиокислительной активности
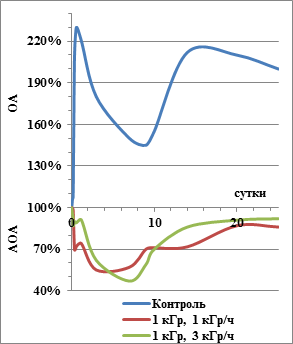
Рис. 4. Изменение РС экзометаболитов A. polychromogenes SN_T61 после воздействия гамма-излучения, низкого давления и низкой температуры. ОА – область окислительной активности; АОА – область антиокислительной активности
Увеличение АОА экзометаболитов согласуется с повышением каталазной активности культуральной жидкости K. rosea после облучения (таблица). В период до 3 суток роста каталазная активность исходного штамма и в облученном варианте была одинакова. Однако в дальнейшем активность культуры после облучения возрастала в 2 раза относительно контроля. Повышение АОА экзометаболитов и увеличение каталазной активности свидетельствует о комплексном ответе антиоксидантной системы исследованных штаммов бактерий на воздействие стрессовых условий.
Влияние гамма-излучения, низкого давления и низкой температуры на каталазную активность культуральной жидкости K. rosea SN_T60. Значение погрешности соответствует стандартному отклонению
|
Время роста, сутки |
Каталазная активность, мл О2/мл культуральной жидкости за минуту |
|
|
Контроль |
Облученный штамм |
|
|
0.5 |
0.05 ± 0.01 |
0.05 ± 0.01 |
|
1 |
0.1 ± 0.02 |
0.1 ± 0.01 |
|
3 |
0.1 ± 0.02 |
0.15 ± 0.02 |
|
7 |
0.1 ± 0.01 |
0.2 ± 0.03 |
|
10 |
0.2 ± 0.02 |
0.4 ± 0.03 |
|
14 |
0.45 ± 0.04 |
0.9 ± 0.02 |
Заключение
Исследованные штаммы бактерий продемонстрировали высокую устойчивость к воздействию гамма-излучения, низкого давления и низкой температуры. Экспонирование в модельных условиях поверхностного слоя марсианского реголита не привело к гибели бактерий, напротив, вызвало активную репродукцию клеток и адаптивную реакцию на стрессовое воздействие. Результаты исследования свидетельствуют о возможности выживания и адаптации бактерий в приповерхностном слое марсианского реголита при заносе на Марс микроорганизмов с Земли или в случае формирования на раннем Марсе биосферы земного типа.
Низкое давление и температура значительно снизили степень радиационных повреждений. В связи с этим можно полагать, что устойчивость и длительность потенциального сохранения микроорганизмов в инопланетных и космических условиях (на объектах, где главным лимитирующим фактором является радиация) недооценена.
Результаты исследования представили новые доказательства взаимосвязанных реакций ответа на множественный стресс у бактерий. Практическая перспектива применения этих знаний лежит как в области совершенствования методов астробиологического поиска (выбора ключевых биомаркеров применительно к объекту исследования), так и развитии новых технологий, в частности, во внеземных условиях.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 13-04-01982), а также при частичной (культивирование и идентификация бактерий) поддержке Российского научного фонда (грант № 14-50-00029).



