Любая практическая деятельность человека реализуется посредством движения. Как полезные результаты, так и негативные эффекты мышечной деятельности во многом лимитируются системой обеспечения углеводного гомеостаза организма, центральным звеном которой является поджелудочная железа [4; 9]. Динамические нагрузки способствуют улучшению обмена глюкозы и липидов, повышают чувствительность тканей к инсулину[1; 3]. Однако до сих пор недостаточно исследованы структурные изменения в органе после физических нагрузок у лиц с нормальной толерантностью к глюкозе и предрасположенных к диабету. Несмотря на большое количество данных о биохимических и гормональных изменениях в организме при различных тренировочных режимах [7; 8], практически отсутствуют результаты исследования поджелудочной железы на тканевом, клеточном и ультраструктурном уровнях организации.
Цель исследования – изучение морфологических изменений элементов поджелудочной железы у животных с нормальной и нарушенной толерантностью к глюкозе после однократной максимальной двигательной нагрузки.
Материал и методы исследования
Объектом исследования послужили беспородные собаки-самцы в возрасте 2-4 лет, содержащиеся в виварии на стандартном рационе питания, предварительно адаптированные к условиям эксперимента (всего 40 животных). Исследование проводили в соответствии с приказом Минвуза СССР №742 от 13.11.84 г. «Об утверждении правил проведения работ с использованием экспериментальных животных». До начала эксперимента по показателям исходного уровня глюкозы крови и результатам стандартного теста толерантности к глюкозе животные были разделены на две группы (с нормальной – группа I (n=20) и нарушенной толерантностью к глюкозе - группа II (n=20). В дальнейшем в каждой из групп были сформированы две подгруппы: интактный контроль (n=10) (без применения нагрузки) и вторая - экспериментальная, с применением однократной нагрузки (n=10). Для воспроизведения двигательной нагрузки в лабораторных условиях использовалась модель бега животных по ленте тредмила со скоростью 15 км/час, которая соответствует 60% максимальной скорости бега большинства собак. Развитие стадий адаптации к физической нагрузке диагностировалось в процессе бега по соотношениям частоты пульса и дыхания [6]. Среднее время бега у животных первой группы составляло 303,8±14,1, у животных с нарушенной толерантностью 167±9,32 минуты. До и после нагрузки биохимическими методами определяли концентрацию глюкозы, лактата и пирувата венозной крови, радиоизотопными – инсулина. Забор материала осуществляли под тиопенталовым наркозом (0,5 мл 10%-ного раствора тиопентала натрия на 1 кг массы животного). Для гистологического исследования материал из хвостовой части железы фиксировали в жидкости Буэна и 10%-ном нейтральном формальдегиде. Парафин-целлоидиновые и парафиновые срезы толщиной 5-7 мкм окрашивали гематоксилином и эозином, хром-гематоксилин-флоксином по Гомори в модификации А.П. Дыбана. Для электронной микроскопии ткань железы фиксировали в 2,5%-ном глутаровом альдегиде, дофиксировали 1%-ным раствором четырёхокиси осмия, заливали в эпон-аралдит. Для идентификации панкреатических островков с последующей прицельной заточкой с каждого блока получали полутонкие срезы, которые окрашивали метиленовым синим, азуром II или основным фуксином. Ультратонкие срезы контрастировали цитратом свинца и уранилацетатом и изучали в электронном микроскопе HU-12A (Hitachi) в трансмиссионном режиме.
Оценку относительных объемов экзокринной и эндокринной частей, экзокринных панкреатоцитов, инсулиноцитов, глюкагоноцитов, их ядер и объемной доли секреторных гранул проводили с использованием программы Image Tools 3.0 при помощи системы анализа изображения МАКС 1005. Цифровой материал обрабатывали с применением методов вариационной статистики с учетом изменчивости признака у каждого животного при использовании стандартных пакетов программ Microsoft Excel 7.0. и Statistica 5.5.
Результаты и их обсуждение
Сравнение динамики биохимических показателей крови у собак первой и второй групп, представленных нами в виде процентного расхождения от контроля (рис. 1), позволяет считать, что реакции утилизации глюкозы у животных с нормальной и нарушенной толерантностью к глюкозе имеет одинаковую направленность. Однако определяемый у второй группы животных меньший прирост пирувата и лактата крови, появление отрицательных корреляционных связей глюкозы с лактатом (r= - 0,817, Р=0,03) косвенно свидетельствуют о наличии дефекта в механизме метаболизма углеводов, что может иметь проявления на различных этапах реакции гликолиза, или утилизации глюкозы. Также обращает на себя внимание положительная корреляция времени бега и концентрации инсулина в крови после нагрузки (r=0,785, Р=0,05).
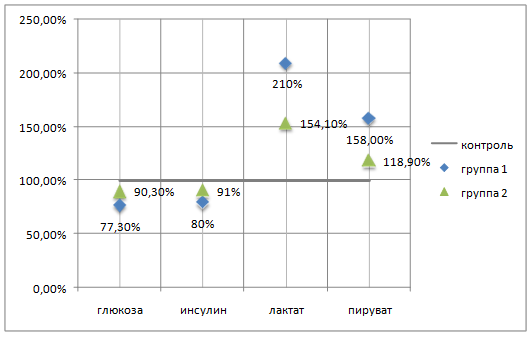
Рис. 1. Процентное расхождение показателей углеводного обмена у животных с нормальной (группа I) и нарушенной (группа II) толерантностью к глюкозе после однократной максимальной физической нагрузки
Однократная максимальная нагрузка у животных обеих групп приводит к полнокровию железы, что на органном уровне проявляется изменением цвета органа, кровенаполнением поверхностных вен. На тканевом уровне организации регистрируется спазм междольковых артериол, диффузное венозно-капиллярное полнокровие, эритростазы. В экзокринной части установлено увеличение относительного объема капилляров на 7,1% (р≤0,05) и индекса кровенаполнения железы на 7,5% (табл. 1). На электронно-микроскопическом уровне выявляются признаки нарушения транскапиллярного обмена, повышения проницаемости сосудистой стенки, усиления трансцитоза. Так, у животных первой группы наблюдается набухание цитоплазмы одних эндотелиоцитов и сплошное осмирование цитоплазмы других клеток.
Таблица 1
Параметры компонентов экзокринной части поджелудочной железы у животных с нормальной (группа I) и нарушенной толерантностью к глюкозе (группа II), X ± Sx
|
Показатели |
Группа I |
Группа II |
||
|
Контроль |
Однократная максимальная нагрузка |
Контроль |
Однократная максимальная нагрузка |
|
|
Объем экзокринной части (%) |
57,39±0,74 |
58,51±0,57 |
51,11±0,78 |
56,62±0,72* |
|
Объем периинсулярных экзокриноцитов (%) |
18,42±0,31 |
16,28±0,57* |
17,58±0,22 |
19,83±0,38* |
|
Объем ядер (%) |
3,67±0,09 |
3,90±0,10 |
3,83±0,03 |
4,21±0,09* |
|
Объем секреторных гранул (%) |
23,43± 0,28
|
19,72±0,42* |
22,12±0,29 |
20,82±0,43* |
|
Объем капилляров (%) |
17,18±0,37 |
18,41±0,33 |
16,27±0,46 |
18,52±0,38* |
|
Индекс кровенаполнения экзокринной части |
0,293±0,006 |
0,315±0,004* |
0,321±0,041 |
0,326±0,071 |
* различия достоверны по сравнению с контролем при р≤ 0,05
У животных с нарушенной толерантностью - в просвете капилляров участки скопления эритроцитов, эндотелиоциты выступают в просвет сосудов, имеют высокую осмиофильность. Ядра некоторых клеток отечны, в цитоплазме - включения крупных вакуолей, набухшие митохондрии. Увеличено количество пиноцитозных везикул и фенестр.
Морфометрически определяется увеличение относительного объема капилляров на 13% (р≤0,05), при этом индекс кровенаполнения достоверно не отличается от контрольных значений (табл. 2).
Таблица 2
Параметры компонентов эндокринной части поджелудочной железы у животных с нормальной (группа I) и нарушенной толерантностью к глюкозе (группа II), X ± Sx
|
Показатели |
Группа I |
Группа II |
||
|
Контроль |
Однократная максимальная нагрузка |
Контроль |
Однократная максимальная нагрузка |
|
|
Объем эндокринной части (%) |
7,92±0,22 |
6,53±0,18* |
8,82±0,22 |
6,84±0,33* |
|
Индекс Ричардсона/Янга |
13,78±0,43 |
11,1±0,36* |
17,22±0,41 |
12,05±0,41* |
|
Объем инсулиноцитов (%) |
7,0±0,22 |
5,70±0,32* |
6,04±0,18 |
4,95±0,18* |
|
Объем ядра (%) |
1,20±0,03 |
1,32±0,02* |
1,10±0,04 |
1,23±0,02* |
|
Объем секреторных гранул в инсулиноцитах (%) |
16,40±0,24 |
14,60±0,58* |
15,51±0,37 |
11,78±0,68* |
|
Объем секреторных гранул без содержимого (%) |
0,40±0,01 |
0,48±0,02* |
0,46±0,02 |
0,39±0,01* |
|
Объем капилляров (%) |
14,28±0,38 |
15,62±0,27* |
14,57±0,18 |
17,14±0,41* |
|
Индекс кровенаполнения эндокринной части |
1,80±0,07 |
2,30±0,06* |
1,60±0,04 |
2,49±0,13* |
* различия достоверны по сравнению с контролем при р≤ 0,05
У животных обеих групп нагрузка приводила к функциональным изменениям эндокринного аппарата. Адаптационная реакция имела одинаковую направленность. На тканевом уровне определялось уменьшение относительного объема островков (на 17,6% у собак первой группы, на 22,5% - во второй), преимущественно за счет снижения относительного объема В-эндокриноцитов (табл. 1, 2). Морфофункциональным перестройкам в большей степени были подвержены инсулиноциты, состояние которых расценивалось нами как высокое функциональное напряжение клетки, о чем свидетельствовало увеличение объема ядер, ядерно-цитоплазматического соотношения. На обзорных ЭГ отчетливо выделялись крупные гипертрофированные ядра, имеющие разнообразную форму (рис. 2). Достоверно уменьшался относительный объем секреторных гранул в цитоплазме клеток, в том числе объемной доли гранул без содержимого (р≤0,05). В то же время в цитозоле регистрировались признаки активации синтеза секрета: увеличение комплекса Гольджи, скопление вблизи трансповерхности секреторных гранул различной степени «зрелости», набухание и просветление матрикса митохондрий. Наряду с этим у животных с нарушенной толерантностью к глюкозе у большей части В-клеток (около 60%) в цитоплазме наблюдалось большое количество гранул с неравномерным распределением секреторного материала в виде отдельных образований или «полосок» (рис. 3). Гранулы с таким содержимым у животных с нормальной толерантностью были единичными и локализовались вблизи комплекса Гольджи. Здесь мы видим их равномерное распределение по всей цитоплазме, и вблизи ядра, и вблизи комплекса Гольджи.
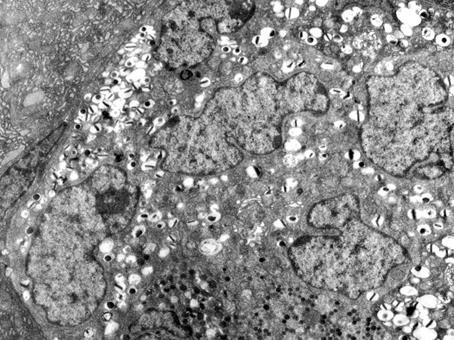
Рис. 2. Панкреатический островок поджелудочной железы у животных с нарушенной толерантностью к глюкозе после однократной максимальной физической нагрузки. Нечеткие границы эндокриноцитов, гипертрофия ядер инсулиноцитов.
Увеличение 3500
Мы склонны считать такие преобразования признаками более интенсивного синтеза инсулина и, видимо, ускоренного выведения секрета, что обусловлено нарушением утилизации глюкозы и измененной инсулинорезистентностью тканей организма [10].
У животных обеих групп нарушения в системе микроциркуляции сопровождались некоторыми преобразованиями в экзокринной части железы. Железа выглядела отечной, междольковые и межацинарные прослойки были расширены. Однако степень выраженности преобразований имела некоторые различия. У собак первой группы в экзокринной паренхиме после нагрузки зарегистрированы деструктивные изменения в панкреатоцитах отдельных ацинусов периферических и центральных отделов. В цитоплазме клеток отмечено
большое число вакуолей, в расширенных цистернах эндоплазматической сети - добавочные полости, в просвете которых выявлен секреторный материал и разрушенные органеллы. В набухших митохондриях появлялись образования типа миелиноподобных структур, на месте разрушенных митохондрий - резидуальные тельца. Однако подобных изменений в периинсуллярных экзокриноцитах зафиксировано не было.
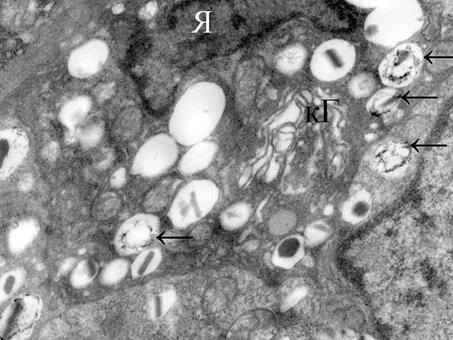
Рис. 3. Инсулиноцит панкреатического островка поджелудочной железы у животных с нарушенной толерантностью к глюкозе после однократной максимальной физической нагрузки. Гипертрофия элементов комплекса Гольджи, неравномерное распределение секреторного материала в гранулах (Я - ядро, кГ- комплекс Гольджи, → секреторные гранулы). Увеличение 8900
Идентично с реакцией инсулиноцитов объем этих клеток снижался на 11,6% (р≤0,05), уменьшался объем секреторных гранул в цитоплазме на 16% (р≤0,05), при этом активность ядра сохранялась. На ультраструктурном уровне выявлялись признаки некоторого понижения белоксинтезирующей функции клетки. Полученные результаты свидетельствуют в пользу сочетанной адаптивной реакции периинсуллярных экзокриноцитов и инсулиноцитов островков [5].
У собак второй группы увеличение относительного объема экзокринной паренхимы составляло 10,7% (р≤0,05). В ацинусах периферических зон были отмечены признаки деструкции экзокриноцитов, в центральных дольках – компенсаторно-приспособительные реакции. Функциональная активность периинсуллярных панкреатоцитов была достаточно высокой - объем клеток увеличивался на 12,7% (р≤0,05), ядер - на 9,9% (р≤0,05). На ЭГ определялась некоторая гипертрофия комплекса Гольджи, скопление гранул зимогена вблизи трансповерхности комплекса и в околоядерной зоне.
Заключение
Таким образом, однократная максимальная нагрузка у животных с различной толерантностью к глюкозе приводит к затруднению венозного оттока от органа и развитию в железе венозно-капиллярного полнокровия.
Нарушения в системе микроциркуляции вызывают структурные преобразования в экзокринной части, проявляющиеся в панкреатоцитах отеком цитоплазмы, деструктивными изменениями в эндоплазматическом ретикулуме и митохондриях.
У животных с нормальной толерантностью к глюкозе снижение синтеза и выведения секрета в В-эндокриноцитах сопровождается появлением элементов деструкций в виде крупных вакуолей вблизи ядра, расширения цистерн эндоплазматической сети, вакуолизации матрикса митохондрий с разрушением и лизисом крист последних.
У животных с нарушенной толерантностью нагрузка вызывает выраженное усиление интенсивности синтеза и активацию выведения секрета в инсулиноцитах с участием в секреторном процессе гранул разной степени зрелости.



