Проблема лечения и профилактики сосудистых заболеваний головного мозга приобретает в последние годы все большую актуальность, что связано с все возрастающей их частотой и имеет не только медицинское, но и важнейшее социальное значение. [1–3]. В РФ ежегодно регистрируется около 400 тыс ОНМК, в структуре которых чаще (70–85 %) встречаются ишемические инсульты [1,2]. Наиболее эффективной мерой профилактики ОНМК, обусловленного окклюзирующим поражением сонных артерий, является каротидная эндартерэктомия (КЭ) [2,4,5,6]. Вместе с тем остаются до конца не решенными некоторые важные вопросы хирургической тактики и техники выполнения операций. Риск периоперационных сосудисто-мозговых осложнений, составляющий от 1,6 % до 24 %, обуславливает повышенные требования к обеспечению адекватной защиты головного мозга от гипоксического повреждения во время пережатия сонной артерии. До 60 % осложнений приходится на интраоперационный период [7,8]. Исследования, посвященные роли фармакологических нейропротекторов и фиксирующие их малую эффективность, в основном посвящены использованию их при ишемии головного мозга de facto. Для ситуации программируемой ишемии (что фактически реализуется во время операции на сонных артериях) возможность прекондиционирования существенно увеличивает эффективность цитопротекции. В нашем исследовании проведен сравнительный анализ возможностей стандартного анестезиологического пособия и ее комбинации с популярными цитопротекторами – мексидолом, актовегином и цитофлавином.
Материал и методы
Открытое простое проспективное исследование проведено на базе отделения сосудистой хирургии, городской клинической больницы № 25 госпитальной хирургической клиники ВолгГМУ и отделения неврологии городского инсультного центра. В исследование вошло 153 пациента, перенесших каротидную эндартерэктомию без использования внутреннего шунта. Основаниями для включения в основную группу исследования являлось наличие стенозов или окклюзии экстрацеребральных артерий с различными проявлениями сосудисто-мозговой недостаточности. Критериями не включения в основную группу явились – отказ пациентов от периоперационного введения нейропротекторов. Критериями исключения явилось: уровень лейкоцитов < 3,5 x 109/л или уровень нейтрофилов < 2,0 x 109/л; любая хирургическая операция/ инфекция в течение последних 8 недель; беременные или кормящие женщины; наличие в прошлом или настоящем тяжелого заболевания сердца; иммунодефицит, ИМ, хронические инфекции. В результате проводимой пробы Матаса оценивалось появление неврологического дефицита после 3-х минутного пережатия общей сонной артерии, а также динамика показателей ТКДГ. При снижении скорости кровотока менее 20 см/с пациент исключался из данной группы, операция в данном случае проводилась с использованием внутрипросветного временного шунта. В контрольную группу вошли 41 оперированный больной, проходивший лечение в отделении сосудистой хирургии, отделении неврологии и городском инсультном центре в этот же период, не получавшие в периоперационном периоде терапии нейропротекторами. С целью профилактики интраоперационных ишемических расстройств использовались стандартные средства: барбитураты (обычно 1 грамм в течение вмешательства), медикаментозная артериальная гипертензия (поддержание систолического артериального давления на уровне 160–180 мм рт. ст.). В зависимости от используемого нейропротекторного препарата больные основной группы были подразделены на 3 подгруппы в зависимости от применяемых препаратов. Пациенты в подгруппах были сопоставимы по возрасту, полу, выраженности неврологической симптоматики и типу выполняемых операций. Их распределение отражено в таблицах 1 и 2.
Таблица 1
Распределение больных в подгруппах в зависимости от выполняемых операций
|
Контрольная группа |
Мексидол |
Актовегин |
Цитофлавин |
Общ. |
|
|
Классическая каротидная эндартерэктомия |
30 (73 %) |
63 (70 %) |
77 (68 %) |
42 (69 %) |
212 (70 %) |
|
Эверсионная каротидная эндартерэктомия |
5 (12 %) |
14 (16 %) |
23 (20 %) |
11 (18 %) |
53 (17 %) |
|
Устранение патологической извитости |
0 (0 %) |
2 (2 %) |
1 (1 %) |
1 (2 %) |
4 (1 %) |
|
Резекция аневризмы сонной артерии |
0 (0 %) |
1 (1 %) |
2 (2 %) |
1 (2 %) |
4 (1 %) |
|
Протезирование ВСА |
6 (15 %) |
10 (11 %) |
10 (9 %) |
6 (10 %) |
32 (10 %) |
|
Всего |
41 (100 %) |
90 (100%) |
113(100%) |
61 (100 %) |
305 (100 %) |
Инфузия начиналась до пережатия сосуда и продолжалась в течение всего периода ишемии головного мозга. Принципиальным моментом явилось то, что среднее время пережатия внутренней сонной артерии во всех трех группах было сопоставимо, разница не достигала достоверных границ различия. В контрольной группе среднее время пережатия ВСА было 23,12 ± 5, 12 минут, в экспериментальных подгруппах первой – 23,8± 4,18 минут, во второй – 24,72 ± 4,98 минут, в третьей – 25,12 ± 3,31 минут.
Таблица 2
Распределение больных в подгруппах в зависимости от степени сосудисто-мозговой недостаточности (СМН) по классификации А. В. Покровского
|
Степень СМН |
Контр. гр. |
Мексидол |
Актовегин |
Цитофлавин |
Общ. |
|
1-ст. (асимптомная) |
5 (12 %) |
5 (6 %) |
6 (5 %) |
5 (8 %) |
21 (7 %) |
|
2-ст. (ТИА) |
3 (7 %) |
4 (4 %) |
4 (4 %) |
4 (7 %) |
15 (5 %) |
|
3-ст. дисциркуляторная энцефалопатия |
4 (10 %) |
16 (18 %) |
25 (22 %) |
12 (20 %) |
57 (19 %) |
|
4-ст. состояние после инсульта |
29 (71 %) |
65 (72 %) |
78 (69 %) |
40 (66 %) |
212 (70 %) |
|
Всего |
41(100 %) |
90(100 %) |
113(100 %) |
61(100 %) |
305(100 %) |
Для атеросклеротического поражения сонных артерий характерен дефект модально-неспецифические процессов, лобных функций регуляции психической деятельности. При этом хирургическое лечение атеросклеротических стенозов по данным ряда авторов [4] благоприятно влияет на ориентировку, восприятие, память, речевые, зрительно-пространственные, регуляторные, гностические и праксические функции у больных с цереброваскулярной патологией. В связи с этим для проведения нейропсихологического обследования нами были использованы следующие методики тестирования: шкала MMSE; батарея лобной дисфункции; шкала общего ухудшения (Global Deterioration Rating); индекс Barthel.
Результаты исследования
Клиническая оценка фармакологической нейропротекции оценивалась по частоте послеоперационных осложнений и динамики неврологического статуса. Используемые нами нейропротекторы не влияют на частоту геморрагических осложнений. Частота послеоперационных гематом колебалась от 4,00 % в третьей группе до 4,44 % в первой группе (p<0,05).
Полученные данные об эффекте влияния в подгруппах актовегина, мексидола и цитофлавина показали большое стандартное отклонение данных, что уменьшает статистическую значимость полученных данных. Для получения статистически достоверного результата нами было принято решение о переходе от шкалы отношений к порядковой шкале, с последующим снижением размерности. В нашем случае за основу была взята классификация выраженности неврологического дефицита. В зависимости от полученных данных было сформировано 4 группы пациентов. Диагностические критерии сортировки в группах представлены в виде таблицы 3. Полученные группы представляли определенные сложности для статистического анализа в связи с малым количеством представленных пациентов в некоторых группах. В связи с этим было принято решение о снижении размерности соответствующих групп путем объединения 1-й и 2-й группы в группу преддементных нарушений (группа 1) и 3-й и 4-й группы в группу деменции (2 группа). Анализу подвергалась динамика изменений количественного состава соответствующих групп. Полученные нами данные убедительно показывают положительный эффект использования каротидной эндартерэктомии в лечении патологии сонных артерий. Так во всех группах отмечается стойкий положительный эффект в послеоперационном периоде, особенно выраженный по результатам 6 месяцев.
Полученные данные отображены в рис. 1–4 и свидетельствуют о положительном эффекте использования реконструктивных вмешательств на синокаротидной зоне в динамике неврологического дефицита.
Таблица 3
Переход от шкалы отношений к порядковой шкале
|
Уровень выраженности поражения |
MMSE |
FAB |
GDR |
Barthel |
|
1 группа – крайне малые нарушения функций |
28-30 |
17-18 |
1 |
101-120 |
|
2 группа – преддементные нарушения |
24-27 |
14-16 |
2 |
86-100 |
|
3 группа – легкая деменция |
20-23 |
12-13 |
3 |
76-85 |
|
4 группа – умеренная и тяжелая деменция |
≤ 19 |
≤11 |
4≥ |
≤75 |
Отмечаются также различия в неврологическом статусе между контрольной группой и группами с использованием нейропротекторов в сроках 24 часа и 7 дней. С течением времени данные различия нивелируются, и к срокам 6 месяцев носят уже, как правило, статистически недостоверный характер. Такая картина распределения результатов говорит о том, что в отдаленных сроках положительный эффект гораздо более связан с положительным влиянием, оказанным на мозговой кровоток реконструктивной операцией, нежели интраоперационной нейропротекцией. С другой стороны, отмечено положительное влияние нейропротективной терапии на ранний послеоперационный период. Отмечено сокращение сроков восстановительного периода, возможностей реабилитации, что свидетельствует об уменьшении повреждающего воздействия, уменьшении выраженности патобиологических механизмов в головном мозге при временной его ишемии-реперфузии. Препарат цитофлавин проявил положительный эффект уже в сроке 24 ч от момента оперативного вмешательства, причем стоит отметить, что ряд показателей (MMSE, FAB) достоверно отличаются от аналогичных показателей, продемонстрированных в группах актовегина и мексидола. В сроках 7 дней положительная корреляция также имела место, но достоверность отличий уже не проявлялась.
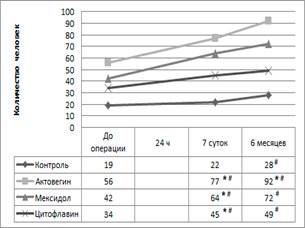
Рис. 1. Динамика Index Barthel
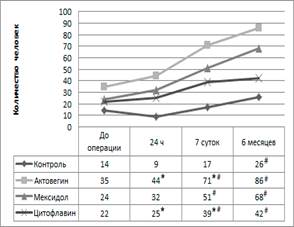
Рис. 2. Динамика GDR
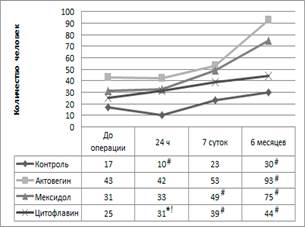
Рис. 3. Динамика FAB
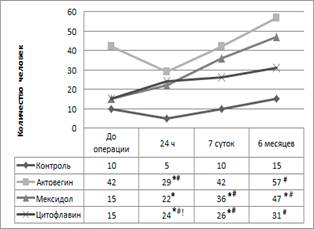
Рис. 4. Динамика MMSE
где * – достоверные различия (Φ0.05> 1,64) с контрольной группой, # – с дооперационным периодом, ! – с другими препаратами.
Заключение
Показан клинический эффект нейропротективной терапии, проявляющийся в сокращении срока восстановления основных неврологических показателей в раннем послеперационном периоде уже к первым суткам послеоперационного периода. Улучшение неврологических показателей оцененных по шкале FAB, GDR, Barthel отмечено при применении всех нейропротективных препаратов. Полученные данные позволяют рекомендовать включение нейропротективных препаратов в схему периоперационного обеспечения пациентов, подвергающихся КЭ. Интраоперационное введение нейропротекторов за 30 минут до момента пережатия общей сонной артерии позволяет уменьшить отрицательное влияние синдрома ишемии-реперфузии на головной мозг, увеличить «оперативное окно» при манипуляциях на сонной артерии, ограничить применение внутрисосудистого шунта.



