Проблема ишемического повреждения мозговой ткани актуальна во всем мире, что объясняется широким распространением, а также высокими показателями временной нетрудоспособности и первичной инвалидизации. В настоящее время широко известно, что патологические состояния, связанные с ишемией/реперфузией, сопровождаются образованием активных форм кислорода с последующей индукцией свободно-радикальных реакций и развитием оксидативного стресса [3]. Усилению этих процессов в мозге способствуют высокая интенсивность аэробных процессов [9] и значительное содержание ионов железа [8]. Чрезмерная активация свободно-радикальных процессов, приводящих к инициации перекисного окисления липидов в мембранах, вызывает повреждение мембранных структур, что усугубляет деструкцию нервных клеток и ведет к гибели нейронов [5].
Цель работы
Изучение особенностей процессов свободно-радикального окисления в мозге крыс с разной устойчивостью к гипоксии в длительной динамике после ишемического повреждения, вызванного остановкой системного кровообращения.
Материалы и методы
Серия экспериментов выполнена на 320 половозрелых самцах неинбредных белых крыс массой 150-180 г, содержавшихся в виварии на стандартном рационе и свободном доступе к воде, после предварительного тестирования на резистентность к гипоксии [1]. По итогам тестирования все животные были разделены на 3 группы - неустойчивые (НУ), среднеустойчивые (СУ) и высокоустойчивые к гипоксии (ВУ). Группы включали по 70 опытных и 10 контрольных крыс. Через неделю после тестирования под общим эфирным наркозом моделировали 5-минутную аноксию интраторакальным пережатием сосудистого пучка сердца по методу [4]. Реанимация проводилась с помощью наружного массажа сердца и искусственной вентиляции легких. Контрольная группа крыс после тестирования на устойчивость к гипоксии подвергалась эфирному наркозу без моделирования аноксии. В 1-е, 3-и, 5-, 7-, 14-, 21-е, 35-е сутки после оживления проводили забой животных под эфирным наркозом. Содержание продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-рп), определяли с помощью набора реактивов «ТБК-АГАТ». С целью изучения интенсивности свободно-радикального окисления (СРО) проводили хемилюминесцентный анализ гомогенатов тканей головного мозга с использованием отечественного хемилюминометра ХЛ-003 с компьютерным обеспечением. Fe2+-индуцированную хемилюминесценцию исследовали по [2]. При оценке Fe2+-индуцированной хемилюминесценции определяли спонтанное свечение (Sp), амплитуду быстрой вспышки (h), амплитуду медленной вспышки (Н), светосумму (SFe2+) по [7]. Статистическая обработка результатов велась с использованием непараметрических критериев Манна-Уитни для независимых выборок.
Результаты и обсуждение
До моделирования аноксии крысы с разной устойчивостью к гипоксии не имели достоверных различий показателей хемилюминесценции (ХЛ) в гомогенатах ткани мозга, за исключением амплитуды быстрой вспышки. В восстановительном периоде после аноксии при изучении ХЛ были получены следующие результаты.
Показатель Sp, характеризующий интенсивность перекисного окисления без вмешательства извне, в ткани мозга высокоустойчивых к гипоксии крыс повышался во все сроки, в том числе значимо на 1-е (на 48%, р=0,031), 7-е (на 44%, р=0,038), 14-е (на 59%, р=0,013) и 35-е сутки (на 63%, 0,014) восстановительного периода (рис. 1). В группе среднеустойчивых к гипоксии животных (рис. 2) значимое повышение спонтанного свечения (3-и сутки в 1,5 раза, р=0,017, 7-е – в 2 раза, р=0,0004, 14-е – в 1,5 раза, р=0,014, 21-е – в 1,9 раза, р=0,0022) сменялось тенденцией к снижению (5-е сутки до 55%, 35-е до 60%). Анализ Sp животных, неустойчивых к гипоксии, не выявил достоверных отличий показателя от контрольных значений, показав лишь тенденцию к снижению практически на всем протяжении постаноксического периода, кроме 3-х и 14-х суток (рис. 3).
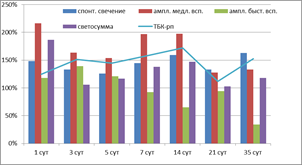
Рис. 1. Показатели свободно-радикального окисления ткани мозга крыс, высокоустойчивых к гипоксии, в восстановительном периоде после остановки системного кровообращения
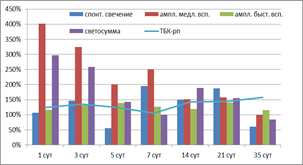
Рис. 2. Показатели свободно-радикального окисления ткани мозга крыс, среднеустойчивых к гипоксии, в восстановительном периоде после остановки системного кровообращения
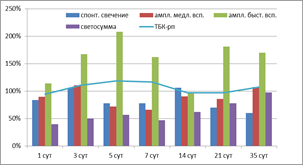
Рис. 3. Показатели свободно-радикального окисления ткани мозга крыс, неустойчивых к гипоксии, в восстановительном периоде после остановки системного кровообращения
Таким образом, высоким базальным уровнем перекисного окисления в ткани мозга в восстановительном периоде после оживления обладают крысы, высокоустойчивые и среднеустойчивые к гипоксии. У животных, неустойчивых к гипоксии, после глубокой ишемии/реперфузии отмечается тенденция к подавлению перекисных реакций, что может быть выражением более значительных расстройств микроциркуляции и доставки кислорода по сравнению с более устойчивыми к гипоксии крысами.
Показатель h (амплитуда быстрой вспышки), характеризующий содержание гидроперекисей в препарате, зависит от скорости окисления ионов двухвалентного железа и образования в среде активных форм кислорода. В восстановительном периоде после остановки системного кровообращения отмечалось накопление гидроперекисей в той или иной степени во всех экспериментальных группах. Стабильно высокими показателями амплитуды быстрой вспышки на уровне 115–140% во все сроки наблюдения при значимых различиях с контролем (р<0,01) отметились СУ животные (рис. 2). У ВУ крыс после некоторого достоверного подъема в 1-е, 3-и, 5-е сутки (р<0,001) наблюдался длительный спад показателя, минимумы определялись на 14-е (до 65% от контроля, р=0,017) и 35-е сутки (до 34% от контроля, р=0,001) (рис. 1). Наибольшее накопление гидроперекисей липидов по результатам ХЛ отмечалось в группе НУ, особенно учитывая, что в контрольной группе этих животных изучаемый показатель был ниже в сравнении с ВУ и СУ соответственно на 44% (р=0,031) и 41% (р=0,022). На фоне высоких параметров h на протяжении всего эксперимента наибольшие подъемы регистрировались на 5-е сутки (208%, р=0,0003), 21-е (181%, р=0,0009) и даже в конце наблюдения (170%, р=0,003) (рис. 3). Кроме того, следует отметить, что в группе неустойчивых к гипоксии животных этот показатель ХЛ был доминирующим. Возможно, увеличение образования активных форм кислорода у этих животных связано с недостаточностью антиоксидантных систем.
Следующий исследованный нами показатель – амплитуда медленной вспышки, косвенно указывающая на содержание субстратов, способных к переокислению, – на всем протяжении восстановительного периода в группах ВУ и СУ держался на высоких цифрах (200–400%) с показателями достоверности р<0,001 практически на всех отрезках измерения. Этот показатель ХЛ был преобладающим среди прочих у животных СУ (рис. 1, 2). Практически обратная картина наблюдалась в последней экспериментальной группе (рис. 3). Вероятно, одним из последствий глубокой тотальной ишемии и последующей реперфузии является истощение субстратов окисления в мозговой ткани, что проявляется достоверным снижением показателей амплитуды медленной вспышки у НУ животных на 1-е (89% от контроля, р=0,041), 7-е (66%, р=0,017) и 21-е сутки (86%, р=0,026). Колебания этого параметра в другие сроки были недостоверными.
Светосумма (SFe2+) отражает способность биосубстрата к развитию цепных процессов окисления при инициации их ионами металлов переменной валентности. По результатам статистического анализа изменения этого показателя практически во все сроки наблюдения и во всех экспериментальных группах являются достоверными (р<0,05). У высокорезистентных животных светосумма была выше контрольного уровня весь период наблюдения, имела две волны подъема с максимумами на 1-е (186%) и 14-е (147%) сутки (рис. 1). Среднерезистентные к гипоксии крысы реагировали более значительным повышением параметра, особенно в 1–3-и сутки (297 и 258% соответственно), но к концу исследования способность липидов мозговой ткани этих животных подвергаться окислению становилась ниже контрольных величин (рис. 2). Группа НУ отвечала резким снижением светосуммы до 39% в первые сутки после моделирования клинической смерти. Далее на протяжении всего эксперимента регистрировался медленный подъем показателя. К 35-м суткам SFe2+ приблизилась к контрольным цифрам, но не достигла их (97%, р=0,597) (рис. 3).
Снижение интенсивности свечения может являться диагностическим признаком повышенного содержания средних молекул, связанного с высокой степенью эндотоксемии [6], неизбежно возникающей после глубокой ишемии/реперфузии. По данным [7] образующиеся в постреанимационном периоде средние молекулы обладают способностью связывать ионы двухвалентного железа и тем самым лишают Fe2+ каталитической активности, что отражается на стадиях инициирования, продолжения и разветвления цепей свободно-радикального окисления.
Определение содержания вторичных продуктов липопероксидации – соединений, реагирующих с тиобарбитуровой кислотой, дало результаты, не противоречащие данным, полученным при исследовании хемилюминесценции. В фоновом содержании ТБК-рп в мозговой ткани экспериментальных животных значимых межгрупповых различий обнаружено не было. Активное накопление ТБК-рп в группе ВУ шло с первых суток восстановительного периода (рис. 1), на 3-и сутки эксперимента статистические различия стали достоверными (151%, р=0,023). Максимум этого параметра определился на 14-е сутки (172%, р=0,0007), но и к концу наблюдения его уровень оставался высоким (153%, р=0,004). В группе СУ (рис. 2) так же, хотя и в меньшей степени, наблюдался рост ТБК-рп, приобретающий статистическую значимость в 3-и (135%, р=0,0101), 14-е (142%, р=0,009), 21-е (143%, р=0,007) и 35-е сутки (158%, р=0,002). Содержание ТБК-рп у животных, неустойчивых к гипоксии (рис. 3), в течение всего периода наблюдений колебалось возле контрольных значений и не имело статически значимых с ними различий.
Заключение
Острая остановка системного кровообращения с последующей реанимацией вызывает рост интенсивности свободно-радикальных процессов и перекисного окисления липидов в ткани мозга, имеющий свои особенности в зависимости от резистентности животных к гипоксии. Относительно небольшая активация этих процессов у неустойчивых к гипоксии животных, вероятно, вызвана быстрым истощением у них субстратов окисления, более значительными расстройствами микроциркуляции и доставки кислорода, так как реперфузия не восстанавливает метаболические капилляры микроциркуляторного русла, а также высокой степенью эндотоксемии с подавлением перекисных реакций.
Рецензенты:
Башкатов С.А., д.б.н., профессор, профессор кафедры генетики и фундаментальной медицины ФГБОУ ВПО «Башкирский государственный университет» МО РФ, г. Уфа;
Каюмова А.Ф., д.м.н., профессор, зав. кафедрой нормальной физиологии ГБОУ ВПО «Башкирский государственный медицинский университет» МЗ РФ, г. Уфа.



