В настоящее время применение монохромного синего света можно наблюдать как в медицинских учреждениях во время лечебных процедур [3], так и для освещения помещений, для которых всё больше используют в целях энергосбережения светодиодные лампы. Эти лампы излучают синие лучи спектра. Известно, что биологические ткани обладают высокой способностью поглощать синий свет из-за активного поглощения его гемоглобином крови[5]. Некоторые исследователи утверждают, что синий свет стимулирует иммунную систему [1]. Известно, что выработка мелатонина подавляется синим светом [4]. Напрашивается вопрос, каким образом происходит повышение иммунитета, если идёт угнетение выработки мелатонина эпифизом, который теснейшим образом связан с иммунной системой [6]. Установлено, что в иммунных процессах участвуют биологически активные вещества [2]. В связи с чем, изучая биологически активные вещества в структурах органов иммунитета при облучении синим светом, можно выявить механизмы его воздействия на эти органы.
Целью данной работы явилось изучение особенностей локализации биоаминсодержащих структур в селезёнке при облучении мышей монохромным светодиодным излучением длиной волны 470нм (синий цвет).
Задачами исследования явились:
1. Выявление морфологических и количественных изменений структур селезенки при облучении мышей синими лучами спектра.
2. Выявить серотониновый индекс (ведущий медиатор) в биоаминсодержащих структурах селезенки при воздействии синими лучами спектра.
Материал и методика исследований
Материалом гистологического исследования была селезёнка 24 мышей-самцов массой 18 гр. Животные были разделены на 2 группы:
1-я – контрольная (12), животные содержались при обычном освещении.
2-я – опытная (12), животные содержались в течение 7 дней при облучении их лампочкой с монохромным светодиодным излучением с длиной волны 470нм (синий цвет) в светлое время суток (с 8.00 до 18.00). Расстояние от излучателя до опытных животных – 30 см – для исключения воздействия теплового эффекта и обеспечения равномерности светового потока.
Все процедуры по уходу за мышами осуществлялись согласно «Правилам проведения работ с использованием экспериментальных животных» (Приказ МЗ РФ от 19.06.2003 № 267).
Органы изымались после гильотинирования. Криостатные срезы свежезамороженных органов толщиной 15 мкм исследовались люминесцентно-гистохимическими методами: метод Фалька-Хилларпа (1962) в модификации Е.М. Крохиной (1969) для выявления моноаминов: катехоламинов (КА) и серотонина (СТ) в содержащих их структурах.Метод основан на реакции конденсации катехоламинов и серотонина с формальдегидом, которые в результате дегидратации превращаются в интенсивно люминесцирующие структуры; метод Кросса с соавт. (1971) для идентификации гистаминсодержащих структур. Метод основан на реакции паров ортофталевого альдегида с гистамином, в ходе которой образуется флуоресцирующее соединение.
С целью определения влияния ведущего нейроамина на общий физиологический процесс определяли серотониновый индекс (Is), являющийся средней от суммы частных соотношений содержания С/КА. Его расчёт проводили по формуле:
IS =S![]() , где St – концентрация серотонина в одной клетке;
, где St – концентрация серотонина в одной клетке;
КА – концентрация катехоламинов в одной клетке;
n – число обследованных клеток;
s – серотониновый индекс.
Метод спектрофлуориметрии использовался для идентификации и количественного выражения уровней СТ, КА и гистамина в тканевых структурах селезёнки. Для этого на люминесцентный микроскоп Лейка ДМ 1000была установлена дополнительная насадка ФМЭЛ-1А. Замер интенсивности свечения производился в единицах флуоресценции (условные единицы (у.е.) по шкале регистрирующего прибора-усилителя).Статистическая обработка полученных цифровых данных проведена с помощью пакета программ Microsoft office. Достоверность результатов оценивалась с помощью непараметрического критерия Манна-Уитни.
Результаты исследований и их обсуждение
Нами при люминесцентно-гистохимическом исследовании селезёнки мышей контрольной группы обнаружены биогенные амины в ГЛК мантийной и маргинальной зон, и в красной пульпе (табл.1). По литературным данным именно ГЛК имеют значение регуляторов автономных функций лимфоидных органов на клеточном уровне [5].
Таблица 1
Интенсивность люминесценции биогенных аминов в цитоструктурах
селезёнки (у.е.)
|
Цитоструктуры |
Контрольная группа |
Опытная группа (синий свет) |
||||
|
КА |
СТ |
Г |
КА |
СТ |
Г |
|
|
ГЛК мантийной зоны |
2,8±0,1 |
2,2±0,2 |
2,8±0,1 |
2,4±0,23* |
2,6±0,3* |
1,2±0,7* |
|
ГЛК маргинальной зоны |
2±0,2 |
1,8±2,2 |
1,8±2,0 |
2,5±1,1* |
2,5±0,23* |
2,6±0,4* |
|
Микроокружение ГЛК маргинальной зоны |
1±0,02
|
1,2±0,6
|
1,1±0,25
|
1,9±0,2*
|
1,9±0,5*
|
3,1±0,3**
|
|
ГЛК красной пульпы |
2,4±0,25 |
2,5±2,2 |
1,7±1,2 |
2,6±0,9* |
2,6±0,7** |
3,6±2,1* |
|
Микроокружение ГЛК красной пульпы |
2,3±0,9
|
2±0,7
|
2,1±0,1
|
1,9±1,2*
|
1,9±0,3*
|
3,1±0,7**
|
Примечание: Г – гистамин, СТ – серотонин, КА – катехоламины
ГЛК – гранулярные люминесцирующие клетки
Р£0,05* – по сравнению с контрольной группой.
Р£0,001* *– по сравнению с контрольной группой.
В контрольной группе селезенки около маргинальной зоны по окружности лимфоидных узелков определялась цепочка из 12-15 крупных ГЛК, люминесцировавших ярко-желтым свечением (рис. 1, 2).В области мантийной зоны лимфоидных узелков определялись средней величины одиночные клетки (рис. 1, 2). Они люминесцировали так же интенсивно, как клетки маргинальной зоны (табл. 1).
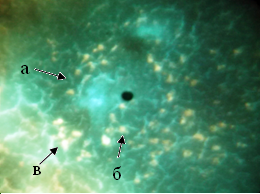
Рис. 1. Локализация КА и серотонина в структурах селезёнки контрольной группы мышей: а - лимфоидный узелок; б - гранулярная люминесцирующая клетка мантийной зоны; в - гранулярная люминесцирующая клетка маргинальной зоны. Метод Фалька. Лейка ДМ 1000. Об. 40. Гомаль 1,7
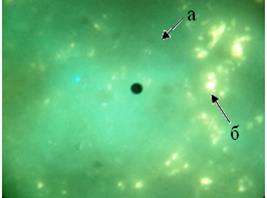
Рис. 2. Локализация гистамина в структурах селезёнки контрольной группы мышей: а - лимфоидный узелок; б - гранулярная люминесцирующая клетка маргинальной зоны. Метод Кросса. Лейка ДМ 1000. Об. 40. Гомаль 1,7
В красной пульпе определялись многочисленныедо 15-20 в одном поле зрения клетки размерами 15-16 мкмс крупными гранулами (рис. 3). Они люминесцировали насыщенным желтым свечением. У некоторых из них гранулы были разнокалиберными. Известно, что часть ГЛК относится к макрофагам, а часть из них принадлежит к клеткам APUD-системы[5].
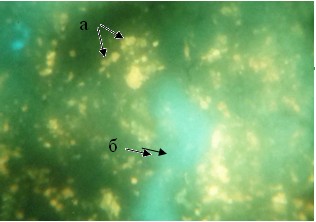
Рис. 3. Локализация КА и серотонина в красной пульпе селезёнки контрольной группы мышей: а - гранулярная люминесцирующая клетка; б - кровеносный сосуд. Метод Фалька. Лейка ДМ 1000. Об. 40. Гомаль 1,7
После семидневного облучения мышей синим светом при исследовании на гистамин выявлено, что в мантийной зоне ГЛК были так же единичными (рис. 4).
Содержание гистамина в них снизилось в 2 раза (табл. 1). При обработке срезов на моноамины обнаружено, что содержание КА в ГЛК мантийной зоны имело тенденцию к снижению (в 0,9 раз), а содержание СТ увеличилось в 1,2 раза (табл. 1).
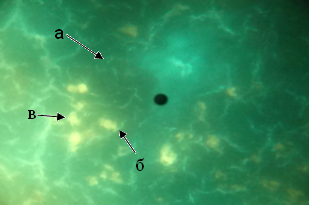
Рис. 4. Локализация КА и серотонина в структурах селезёнки мышей, облучённых синим светом: а - лимфоидный узелок; б - гранулярная люминесцирующая клетка мантийной зоны; в - гранулярная люминесцирующая клетка маргинальной зоны. Метод Фалька.
Лейка ДМ 1000. Об. 40. Гомаль 1,7
В ГЛК маргинальной зоны содержание КА у мышей облученных синим светом возросло в 1,3 раза по сравнению с интактными животными, а содержание СТ и гистамина увеличилось в 1,4 раза (табл. 1). Микроокружение этих клеток содержало больше биогенных аминов, чем у мышей, содержавшихся при дневном свете: КА – в 1,9 раз, СТ– в 1,5 раза, гистамина в 2,8 раз.
Популяция ГЛК красной пульпы селезёнки мышей, облучавшихся синим светом, была немногочисленной и была представлена в основном ГЛК среднего размера.
Содержание КА и серотонина в ГЛК красной пульпы у мышей, подверженных излучению синим светом, увеличилось в 1,1 раз, а содержание гистамина в 2 раза. Микроокружение этих клеток содержало гистамина в 1,5 раз больше чем у мышей контрольной группы, а содержание КА и серотонина имело тенденцию к снижению (КА в 0,8 раз, СТ в 0,9 раз).
Вдоль стенок сосудов определялись крупные овальные клетки, люминесцирующие ярким желтоватым свечением. Внутри клеток были различимы одинаковой величины гранулы. При параллельных окрасках по Унна такие клетки относятся к тучным.
Установлено, что у мышей контрольной группы серотониновый индекс в ГЛК мантийной и маргинальной зон лимфоидных узелков был ниже единицы (табл.2). А в ГЛК красной пульпы составил единицу. У мышей облучённых синим светом, этот показатель во всех цитоструктурах был выше единицы.
Таблица 2
Серотониновый индекс в цитоструктурах селезёнки
|
Цитоструктуры |
ГЛК мантийной зоны |
ГЛК маргинальной зоны |
ГЛК красной пульпы
|
|
Контрольная группа |
0,8±0,03 |
0,9±0,1
|
1,1±0,05
|
|
Опытная группа (синий свет) |
1,1±0,17** |
1±0,14* |
1±0,12**
|
Примечание: Р£0,05* – по сравнению с контрольной группой.
Р£0,001* *– по сравнению с контрольной группой.
Таким образом, нами было установлено, что у опытной группы мышей влияние нейроаминов в ГЛК селезенки было разным. В ГЛК мантийной зоны ведущим медиатором был серотонин, а в остальных соответствующих зонах в ГЛК действие КА и СТ на эти структуры были равными, т.е. влияние адренергического звена ВНС и действия серотонина как супрессора.
Выводы:
1. Облучение монохромным синим светом, увеличивает выработку биогенных аминов в ГЛК маргинальной зоны и ГЛК красной пульпы селезенки.
2. Под действием синего света увеличиваетсясодержание серотонина и снижается содержание КА и гистамина в ГЛК мантийной зоны.
3. У мышей, облучённых синим светом, преобладающим медиатором был серотонин.
Рецензенты:
Денисова Т.Г., д.м.н., профессор, проректор по научной работе и информатизации АУ Чувашии «Институт усовершенствования врачей» Минздравсоцразвития Чувашии, г. Чебоксары;
Сергеева В.Е., д.б.н., профессор кафедры медицинской биологии с курсом микробиологии ФГБОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова», г. Чебоксары.



