Технологический процесс получения стали из ОМП осуществляется в несколько этапов:
- огнеупорная форма заполняется смесью ОМП – термитной смесью (ТС);
- ТС воспламеняют, и в форме проходит экзотермическая окислительно-восстановительная реакция с образованием расплава металла и шлака;
- жидкий металл заполняет литейную форму, а шлак всплывает к ее верхней части [5, 6, 7, 3].
Экспериментально установлено, что:
- полнота восстановления химических элементов при прохождении экзотермической реакции зависит от ее температуры;
- на интенсивность экзотермической реакции оказывает влияние соотношение компонентов в ТС;
- алюмотермитный переплав ТС сопровождается кратковременным выбросом газовой фазы, разбрызгиванием шлака и расплава металла.
Кроме того, при повышении температуры проходящей реакции масса выхода восстановленного металла снижается вследствие угара его основных компонентов и негативно сказывается на структуре металлоизделия появлением газовой пористости и рыхлот.
Снижение температуры химической реакции и интенсивности алюмотермитного переплава возможно применением компонентов ТС, содержащих натрий (Na) и калий (К), позволяющих получить качественный металл при пониженных температурах и способных влиять на жидкоподвижность образующегося при окислительно-восстановительном процессе шлака.
Известно [1], в металлургической практике компоненты, содержащие Na и K, широко используются для снижения содержания серы и фосфора в расплаве стали, которые впоследствии переходят в шлак, повышая его технологические свойства, снижая температуру плавления. На основании вышеуказанного в качестве деактиваторов термохимического процесса окислительно-восстановительной реакции алюмотермитного переплава ОМП использовались доступные хлориды калия и натрия.
Таким образом, целью исследования является изучение влияния KCl и NaCl на процесс получения и свойства стали при алюмотермитном восстановлении железа из ОМП.
Задачами исследований ставились:
- определение влияния деактиваторов на интенсивность окислительно-восстановительного процесса и массовый выход металла;
- изучение влияния деактиваторов на свойства получаемых сплавов.
Теоретический расчет температуры реакции
Для описания окислительно-восстановительного процесса ОМП используется реакция
2Al + 3FeO → Al2O3 + 3Fe + Q, (1)
где Q – тепловой эффект реакции, равный 3265 кДж/кг. В качестве восстановителя применяли алюминий. Согласно (1), восстановление железа из окислов происходит при содержании в исходной шихте 25% восстановителя и 75% окалины. При использовании восстановителя в количестве 25–50 % часть его избыточного содержания, по сравнению с (1), окисляется кислородом воздуха и переходит в шлак, а оставшаяся – в металл:
4Al + 3O2 → 2 Al2O3. (2)
При этом наблюдается повышенное (до 25% в сравнении с (1)) образование шлака и повышенное (до 7%) содержание остаточного Al в металле.
Вводимый в ТС деактиватор, например NaCl, при определенных условиях может взаимодействовать с двумя основными компонентами Al и FeO по следующим реакциям:
Al + 3NaCl → AlCl3 + 3Na – 2619 кДж/кг, (3)
FeO + 2NaCl → FeCl2 + Na2O – 1741 кДж/кг. (4)
Согласно (3) и (4) представленные реакции эндотермические, проходят с поглощением тепла. Поэтому в нормальных условиях протекание реакций Al – NaCl и FeO – NaCl возможно при затратах тепла по реакции (1). Компонент NaCl при определенных условиях может взаимодействовать с продуктами реакции (1) Fe + Al2O3 по формулам:
2NaCl + 2Fe → Na20 + 2FeCl2 – 2764 кДж/кг, (5)
Al2O3 + 6NaCl → 3Na2O + 2AlCl3 – 3274 кДж/кг. (6)
Из (5) и (6) видно, что протекание реакций в нормальных условиях идет с поглощением тепла, которое может быть заимствовано из реакции Al – FeO. Однако существование устойчивых соединений при высоких температурах и количестве выделившегося тепла на основе компонентов NaCl представляется затруднительным, следовательно, реакция разложения NaCl наиболее вероятна. При этом наблюдается выход Cl2 в виде газа и появление Na, который, в свою очередь, взаимодействует с компонентами ТС по реакции
2Na + FeO → Na2O + Fe + 1271 кДж/кг. (7)
Однако количество получаемого Na мало по сравнению с основным восстановителем Al, поэтому нет необходимости учитывать в тепловом балансе теплотворные способности данных компонентов.
Таким образом, формула теплового баланса реакции с учетом внесения в термитную смесь NaCl, согласно [2, 8] может быть представлена в следующем виде:
Qреакц = Qтерм – Qразл NaCl, (8)
где Qреакц – теплотворная способность ТС с введенным в нее регулятором, кДж/кг; Qтерм – теплотворная способность ТС, состоящей из Al и FeO, кДж/кг; Qразл NaCl – теплота разложения NaCl на его составляющие Na и Cl, кДж/кг. Теоретическую теплотворную способность рассчитаем по следующей формуле:
Qтерм = Qтеор ∙ mтерм – (LAl2O3 ∙ m Al2O3 + LFe ∙ mFe) – (СpAl2O3 ∙ m Al2O3 + CpFe ∙ mFe) ∙ Tтерм, (9)
где Qтеор – теоретическая теплотворная способность ТС, кДж/кг; mтерм – масса ТС, кг; LAl2O3 – теплота плавления Al2O3, кДж/кг; mAl2O3 – масса образующегося в результате термитной реакции Al2O3, кг; LFe – теплота плавления Fe, кДж/кг; mFe – масса образующегося термитного железа, кг; СpAl2O3 – теплоемкость Al2O3, кДж∙К/кг; CpFe – теплоемкость Fe, кДж∙К/кг; Tтерм – температура ТС, °С.
Теплота разложения NaCl на составляющие определяется из соотношения
Qразл NaCl = – Qразл ∙ mNaCl – (LNa ∙ mNa + LCl ∙ mCl) – (СpNa ∙ mNa + CpCl ∙ mCl) ∙ Tреакц, (10)
где Qразл – теоретическая теплопоглощающая способность NaCl при его разложении, кДж/кг; mNaCl – масса вступающего в термитную реакцию NaCl, кг; LNa – теплота плавления Na, кДж/кг; LCl – теплота плавления Сl, кДж/кг; mCl – масса вступающего в термитную реакцию Cl, кг; СpNa - теплоемкость Na, кДж∙К/кг; CpCl – теплоемкость Сl, кДж∙К/кг; Tреакц – температура реакции, °С.
Аналогичное справедливо при использовании в составе ТС деактиватора KCl. Отличием является его более высокая химическая активность, выраженная более высоким тепловым эффектом при взаимодействии с FeO, чем у NaCl.
По представленной методике произведен расчет температур экзотермической реакции в зависимости от количественного содержания различных деактиваторов в ТС. Результаты расчетов сведены в графические зависимости, которые представлены на рис. 1. Критерием оценки эффективности взаимодействия хлоридов являлась температура разложения окалины Fe3O4 или FeO-Fe2O3, являющейся продуктом окисления Fe на воздухе, которая составляет 1539 °С.
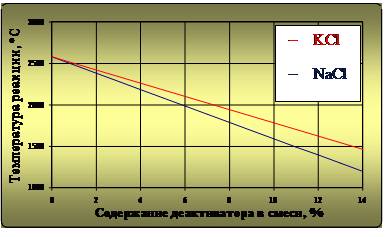
Рис.1. Зависимость температуры реакции от содержания деактиваторов в термитной смеси
Экспериментально определено, что содержание NaCl в ТС более 10 % по массе приводит к замедлению или полной остановке термохимического процесса восстановления Fe, значительному ухудшению свойств получаемого металла и представляется нецелесообразным.
Для KCl зависимости температуры реакции от количества содержания деактиватора в ТС также носят линейный характер и отличаются углом наклона. Предельно допустимое значение KCl в составе ТС ограничено 14%.
Экспериментальные исследования реакции
Целесообразность практического использования рассматриваемых деактиваторов также определялась зависимостями массового выхода восстановленного металла и временем горения ТС (интенсивностью реакции) от содержания в ней компонентов NaCl и KCl по массе. Экспериментальная зависимость массового выхода металла от содержания деактиваторов в шихте по массе представлена на рис. 2, а зависимость времени горения ТС– на рис. 3.
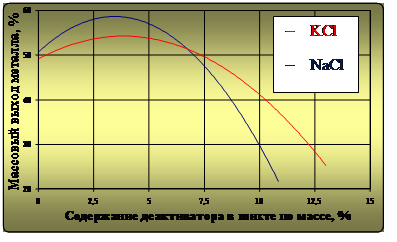
Рис. 2. Зависимость массового выхода металла от содержания деактиваторов в термитной смеси
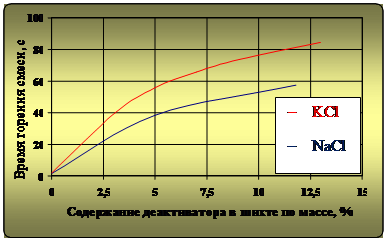
Рис. 3. Зависимость времени горения термитной смеси от содержания в ней деактиваторов
Анализ зависимостей массового выхода восстановленного металла от содержания деактиваторов в ТС при прохождении алюмотермитного процесса показал, что наибольшая его эффективность достигается при 3,5% для NaCl и 4% для KCl. В рассматриваемом случае массовый выход металла, по отношению к массе ТС, составил 57–58% для NaCl и 55% для KCl. В данном случае соотношения компонентов ТС и деактиваторов формируют одинаковую температуру экзотермической реакции (рис. 1) – 2250 °С. Однако К, как более активный элемент, организует более сложную схему термохимического процесса и может принимать менее активное участие в восстановлении Fe, восстанавливая при своем окислении другие элементы ТС и переходя в шлак.
Разветвленная схема взаимодействия KCl с химическими элементами ТС также более чем в 1,5 раза увеличивает время горения последней (рис. 3) по сравнению с NaCl при прочих равных условиях.
Из анализа кривых, представленных на рис. 2 и рис.3 следует, что:
– при использовании NaCl и KCl массовый выход металла при горении ТС выше расчетных 50 % и экспериментальных 47 %. При превышении их содержания более 7 % и 7,25 % соответственно, массовый выход металла сокращается ниже теоретических значений;
– применение в составе ТС NaCl и KCl являются эффективными для увеличения времени горения, что при необходимости обеспечивает более полное взаимодействие компонентов последней и разделение продуктов реакции, т.е. всплытие шлака.
При использовании указанных деактиваторов получена сталь по химическому составу соответствующая Ст3. Для изучения влияния NaCl и KCl на свойства получаемой алюмотермитным переплавом стали проведен анализ структур образцов. На рис. 4 представлены макроструктуры в местах изломов образцов, полученных с присутствием в составе ТС NaCl – 3,5 % и KCl – 4%.


а) б)
Рис. 4. Макроструктуры
изломов образцов, полученных с применением деактиваторов:
а – NaCl; б – KCl
При визуальном анализе образцов, представленных на рис. 4, пористости и рыхлот на поверхности изломов не обнаружено.
Заключение
Экспериментальные исследования показали, что эффективное воздействие на прохождение экзотермической реакции возможно при условии применения составе ТС в качестве деактиваторов хлорсодержащих компонентов, таких как NaCl и KCl. Их содержания в ТС < 7 % и < 7,25 % соответственно позволяет повысить эффективность алюмотермитного процесса увеличением объемов получаемого расплава металла, сократить количество газовых включений в структуре металла вследствие снижения интенсивности экзотермического процесса, стабилизировать физико-механические свойства стали.
Работа выполнена при финансовой поддержке Министерства образования и науки Российской Федерации в рамках базовой части государственного задания в сфере научной деятельности (проект №2559).
Рецензенты:Буренин А.А., д.ф.-м.н., профессор, директор ФГБУН Института машиноведения и металлургии Дальневосточного отделения Российской академии наук, г. Комсомольск-на-Амуре.
Козин В.М., д.т.н., профессор, зав. лабораторией механики деформирования, ФГБУН Институт машиноведения и металлургии Дальневосточного отделения Российской академии наук, г. Комсомольск-на-Амуре.



