У каждого пятого ребенка при гипертензивных расстройствах у матери во время беременности диагностируется синдром задержки внутриутробного развития, а в тяжелых случаях – дистресс–синдром и гибель плода [9, 10]. До 18% случаев антенатальной гибели связано с АГ при беременности [4]. Степень влияния патологических факторов на плод определяется длительностью гипертензивных нарушений и тяжестью клинических проявлений [1].
При гипертензивных расстройствах во время беременности патологические изменения развиваются и в плаценте – связующем звене функциональной системы «мать-плацента-плод». На сегодняшний день в отечественной и иностранной литературе достаточно полно представлены патоморфологические особенности плацент при беременности, осложненной ПЭ. Определены механизмы развития острых и хронических расстройств маточно-плацентарного кровообращения, детализированы варианты нарушений созревания ворсинчатого хориона, выявлены особенности воспалительных и дистрофических изменений в плаценте, дана подробная характеристика процессов адаптации и компенсации при ПЭ разной степени. Показано, что соотношение общепатологических процессов и степени выраженности компенсаторных реакций определяют стадию хронической плацентарной недостаточности при данном осложнении беременности [1, 2, 3].
В единичных работах изложены общие представления об особенности структурной перестройки в плаценте при гипертонической болезни, артериальной гипертензии у женщин, и практически отсутствуют сведения о морфологической картине последа при преэклампсии на фоне ХАГ. Патогенетическая значимость этих осложнений беременности представляет несомненный интерес для определения плацентарных факторов развития данного осложнения беременности, перинатальной заболеваемости и смертности.
Цель исследования
Сравнительный анализ патоморфологических изменений в последах женщин с ХАГ и при сочетании ее с ПЭ.
Материал и методы исследования
В соответствии с целью исследования проанализированы особенности структурной перестройки в 34 последах, от женщин, беременность у которых протекала на фоне ХАГ (I группа) и в 28 последах – от пациенток с ХАГ с присоединившейся ПЭ (II группа). Группу контроля составили 20 плацент, полученных от женщин, у которых при беременности не было признаков АГ. С плацентарной ткани, фиксированной в 10% растворе нейтрального формалина, после стандартной парафиновой проводки готовились срезы, окрашивались гематоксилином Эрлиха и эозином. Комплексная оценка структурных особенностей плацент включала макроскопическую диагностику, органометрию и обзорную гистологию
Средний срок родоразрешения в группе контроля составил 39 недель. Органометрические параметры плацент: линейные размеры, масса и площадь материнской поверхности соответствовали сроку гестации. В данной группе преобладали плаценты овальной формы с парацентральным прикреплением белесоватого умеренно извитого пупочного канатика с очаговой дилатацией и полнокровием пуповинной вены в витках. При обзорном гистологическом исследовании в 2% случаев выявлен мелкоочаговый тромбоз межворсинчатого пространства, рассеянные мелкоочаговые ишемические инфаркты (3%) и отложения фибрина в зонах некроза эпителия ворсин, в базальной пластинке и в периферическом цитотрофофбласте.
Результаты исследования и их обсуждение
В ходе клинической характеристики женщин исследуемых групп выявлены следующие особенности. Средний возраст у пациенток первой группы составил 34,8±1,6 лет и был достоверно выше (p=0,002) аналогичного параметра в группе контроля (28,4±1,31лет) за счет беременных старше 36 лет (p=0,01). Во второй группе средний возраст женщин не имел достоверных различий от первой группы и контроля (32,38±1,84 лет), (p>0,05). Пациентки первой группы чаще были неработающими по сравнению с группой контроля (p=0,01) и со второй группой (p=0,05). У беременных с ХАГ вне зависимости от присоединения преэклампсии чаще встречалась наследственная предрасположенность к гипертонической болезни по сравнению с контрольной группой (p=0,001в обоих случаях). Данные анамнеза о характере становления менструальной функции в сравниваемых группах не отличались. Среди гинекологических заболеваний у женщин первой группы чаще имело место бесплодие по сравнению с группой контроля и со второй группой (p=0,02; p=0,01). Беременные второй группы чаще страдали воспалительными заболеваниями органов малого таза по сравнению с первой (p=0,01). В структуре экстрагенитальной патологии у пациенток второй группы чаще, по сравнению с женщинами первой группы, отмечался хронический пиелонефрит (p=0,05), у женщин первой - ожирение (p=0,01 по сравнению с контролем). Пациентки второй и контрольной групп чаще были первобеременными, первородящими по сравнению с женщинами с ХАГ (p=0,05 в обоих случаях). В свою очередь женщины первой группы чаще по сравнению с группой контроля (p=0,001) и со второй группой (p=0,05) были повторнородящими, имеющими в анамнезе преждевременные роды.
При постановке на учет по беременности женщины первой и второй групп имели больший индекс массы тела, более высокое среднее артериальное давление по сравнению с контролем (p=0,001 в обоих случаях). При этом общая прибавка массы тела за беременность была выше (p=0,001) у пациенток второй группы по сравнению с контролем и с первой группой. В момент госпитализации в стационар среднее артериальное давление во второй группе составило 119,44±3,36 мм.рт.ст. и было достоверно выше аналогичного параметра в первой (108,07±1,92 мм.рт.ст.) и контрольной группах (86,74±1,69 мм.рт.ст.), (p=0,01, p=0,001). Уровень протеинурии в однократной порции мочи при поступлении был достоверно выше у женщин с гипертензивными нарушениями по сравнению с контролем, максимальным в группе ХАГ с присоединившейся ПЭ - 0,75±0,25 г/л (p=0,02). Среди осложнений беременности у женщин второй группы по сравнению с пациентками первой группы чаще отмечались ранний гестоз и синдром задержки развития плода (p=0,05 в обоих случаях).
Средний срок родоразрешения в группах с гипертензивными нарушениями был достоверно ниже аналогичного показателя контрольной группы (p=0,001), минимальным - в группе с ХАГ и с присоединившейся ПЭ (p=0,03 по сравнению с группой ХАГ). У всех женщин контрольной группы беременность закончилась своевременными родами. В свою очередь у 33,3% женщин с ХАГ, и у 62,5% с ХАГ с присоединившейся ПЭ беременность завершилась преждевременными родами. Дети женщин с гипертензивными расстройствами при рождении имели более низкие фетометрические параметры (p=0,001), низкую оценку по шкале Апгар на 1 и 5 минутах (p=0,02; p=0,04) по сравнению с контрольной группой. Также в группах женщин с гипертензивными нарушениями чаще рождались дети в состоянии тяжелой асфиксии и с признаками задержки роста плода по сравнению с контрольной группой (p=0,02 в обоих случаях).
По данным морфологического исследования плацент установлено, что в группе женщин с ХАГ, как и в группе контроля, доминировали плаценты округлой и овальной форм. Средняя масса плацент в данной группе составила 413,36±22,12 г., площадь материнской поверхности 239,96 ± 13,44 см2 . При анализе органометрических параметров плацент данной группы в 48,15% случаев диагностирована гипоплазия органа. Среди гипоплазированных плацент с одинаковой частотой выявлены гипоплазия II и III степеней. На плодовой поверхности 14 (41,18%) плацент определялся белесоватый ободок. Достоверно чаще в плацентах при ХАГ, в отличие от контрольной группы, обнаружено краевое и оболочечное прикрепление пуповины с промежуточным и рассыпным типом ветвления сосудов (p<0,05). Более чем в половине случаев (56%) в умеренно и резко извитой пуповине диагностировано варикозное расширение вены, сочетающееся в 40,6% случаях с гипоплазией вартонова студня. Аналогичное сочетание гипоплазии плаценты с аномалиями формами органа и атипичным прикреплением пупочного канатика получено и в ранее проведенных исследованиях [1].
При гистологическом исследовании в плацентах женщин с ХАГ в 87,7% случаев диагностированы нарушения материнского и плодового кровотока в виде острых и хронических геморрагических (20,4%), а также ишемических инфарктов (44,8%), очагового стаза (22,2%) межворсинчатого пространства и мелкоочаговой отслойки нормально расположенной плаценты (12,6%). В единичных случаях (5%), как и в группе контроля, диагностирован тромбоз межворсинчатого пространства центральных и суббазальных зон. Расстройства материнско-плодового кровотока сочетались с повышенным в отличие от группы контроля отложением фибрина и фибриноида (42,7%) в базальной пластинке и в зонах некроза эпителия ворсин. Дистрофические изменения и расстройства маточно-плацентарного кровотока инициировали развитие процессов адаптации и компенсации, среди которых преобладала очаговая гиперплазия терминальных ворсин (39,4%) и синцитиальных почек (45,5%). В 10 (29,4%) и 7 (20,6%) плацентах женщин с хронической артериальной гипертензией обнаружена гиперплазия капилляров и синцитиокапиллярных мембран. При анализе патоморфологических изменений и степени выраженности процессов адаптации и компенсации у 21 женщины (65,6%) диагностирована хроническая плацентарная недостаточность, из них в 71,4% случаев - субкомпенсированная и в 28,6% – компенсированная.
В группе женщин с ПЭ на фоне ХАГ так же, как в группе контроля, преобладали плаценты овальной и округлой форм. Средняя масса плацент данной группы составила 389,60 ±31,56 г, а площадь материнской поверхности - 212,74 ±15,25 см2 . В данной группе в 62,5% случаев выявлена гипоплазия плацент. Следует подчеркнуть, что доминировали тяжелые формы гипоплазии: в 18,25% случаев - гипоплазия II степени, в 31,25% - гипоплазия III ст. В четыре раза чаще в отличие от группы контроля имело место краевое прикрепление резко извитой пуповины. Достоверно чаще по сравнению с группой контроля определялась гипоплазия вартонова студня в зоне прикрепления и по ходу пуповины.
При патоморфологическом исследовании плацент от женщин с ПЭ на фоне ХАГ диагностированы средне- и крупноочаговые хронические геморрагические (55,6%) и ишемические (44,8%) инфаркты, которые сочетались с очаговым тромбозом межворсинчатого пространства (33,3%). В двух случаях имела место очаговая отслойка плаценты, в одном - апоплексия плаценты. Характерной особенностью плацент и морфологическим подтверждением хронической плацентарной гипертензии в данной группе явилась структурная перестройка сосудов стволовых ворсин в виде стеноза просвета артерий и дилатация вен стволовых ворсин I и II порядков. Из дистрофических изменений выявлено повышенное отложением фибрина и фибриноида в зонах некроза эпителия ворсин. В базальной пластинке и зонах локализации периферического цитотрофобласта увеличен удельный объем фибрина с формированием очагов фибриноидного некроза.
Процессы компенсации в плацентах женщин с ПЭ на фоне ХАГ выражены крайне скудно и представлены мелкоочаговой гиперплазией терминальных ворсин, капилляров и синцитиокапиллярных мембран в ворсинах. Из компенсаторных процессов превалировала гиперплазия синцитиальных почек, являющаяся результатом компенсации недостаточной васкуляризации терминальных ворсин (рис.1). В плацентах данной группы доминировали адаптационные процессы в виде полнокровия капилляров промежуточных и терминальных ворсин, расположенных в краевых и парацентральных отделах. Полученные результаты не расходятся с данными ряда исследователей о морфометрических параметрах васкуляризации ворсин и частоте нарушений материнского и плодового кровотока при преэклампсии [5]. С учетом уровня формирования процессов адаптации и компенсации в плацентах женщин с ПЭ на фоне ХАГ в 81,3% случаев диагностирована хроническая плацентарная недостаточность (ХПН), из которой ХПН в 69,2% - субкомпенсированная и в 31,8% - компенсированная.
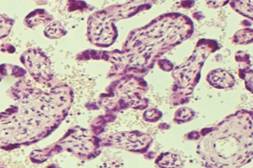 .
.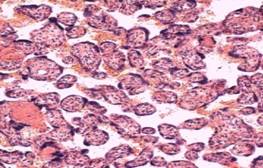
Рисунок 1. Рисунок 2.
Рисунок 1. Плацента 33 недель гестации при беременности, осложненной ПЭ на фоне ХАГ. Гиперплазия синцитиальных почек. Окраска гематоксилином и эозином х 225.
Рисунок 2. Плацента 35 недель гестации при беременности, осложненной ПЭ на фоне ХАГ.
Гиповаскуляризация промежуточных и терминальных ворсин. Окраска гематоксилином и эозином х 170.
При сравнительном анализе патоморфологических изменений в плацентах от женщин с ХАГ и при сочетании ХАГ с ПЭ выявлено следующее. Плаценты по форме (округлая и овальная) и особенностям прикрепления пуповины (парацентральное и краевое) без достоверных различий. Достоверно не отличаются плаценты в сравниваемых группах и по частоте встречаемости ложных узлов пуповины и гипоплазии вартонова студня как в месте прикрепления, так и по ходу пуповины. Масса плацент от женщин с ПЭ на фоне ХАГ достоверно ниже аналогичных параметров в группе плаценте при ХАГ, что связано с более низким сроком гестации и большей частотой гипоплазии провизорного органа (p<0,05). Гипоплазия плацент II степени диагностирована с одинаковой частотой (18%, 25%) в сравниваемых подгруппах, а гипоплазия III степени определялась достоверно чаще (31,25%) в плацентах женщин при ПЭ на фоне ХАГ (р=0,05).
Из общепатологических процессов в плацентах сравниваемых групп диагностировано сочетание расстройств маточно-плацентарного кровообращения с дистрофическими изменениями эпителия и стромы ворсин. Следует отметить, что в плацентах при ПЭ на фоне ХАГ достоверно чаще встречались расстройства маточно-плацентарного кровообращения в виде геморрагических инфарктов, очагового тромбоза и стаза в межворсинчатом пространстве суббазальных и центральных зон (p=0,05). Инфаркты преимущественно локализовались в центральных и парацентральных отделах и занимали от 17% до 24% площади материнской поверхности плаценты. В группе женщин с ХАГ геморрагические инфаркты локализовались преимущественно в краевых отделах плацент, что имеет меньшую патогенетическую значимость патологических процессов для нарушений плацентарного обмена. Частота встречаемости ишемических инфарктов в сравниваемых группах была статистически недостоверной. Вирусно-бактериальное воспаление в виде базального и париетального децидуита в 2,5 раза чаще выявлялось в плацентах при ПЭ на фоне ХАГ. Дистрофические изменения с отложением фибрина в периферическом цитотрофобласте, эпителии ворсин и базальной пластинке с одинаковой частотой диагностировались как при ХАГ, так и при ПЭ на фоне ХАГ. Крупноочаговый фибриноидный некроз, как и повышенное отложение фибрина в базальной пластинке, определялись в плацентах при ПЭ на фоне ХАГ (р=0,001).
Выраженность процессов адаптации и компенсации в с плацентах сравниваемых групп отличалась вариабельностью. Адаптационные изменения в виде полнокровия и дилатации капилляров промежуточных и терминальных ворсин равноценны в плацентах обоих групп. Такие компенсаторные процессы как гиперплазия терминальных ворсин и капилляров достоверно чаще определялись в плацентах с ХАГ и составили соответственно 39,4% и 31,4% (р=0,02). Одной из основных причин недоразвития компенсаторных процессов в плаценте при ПЭ на фоне ХАГ является преобладание гипоплазированных плацент III степени с поствоспалительной гиповаскуляризацией ворсин (рис.2). Недостаточность обменных процессов в таких плацентах компенсировалась гиперплазией синцитиальных почек. В плацентах при сочетании ПЭ с ХАГ достоверно чаще в отличие от плацент при ХАГ диагностирована хроническая плацентарная недостаточность (81,4%, р=0,02). Субкомпенсированная форма ХПН в два раза превышала компенсированную в каждой из групп.
Заключение
Таким образом, основными патоморфологическим изменениями в плацентах женщин с ХАГ являются гипоплазия органа II степени, краевые хронические геморрагические инфаркты, дистрофические изменения эпителия и стромы ворсин. Плаценты при сочетании ПЭ и ХАГ характеризуются нарушением развития плаценты на стадии фетализации с формированием гипоплазии органа III степени. Гипоплазия плацент в сочетании с хроническими геморрагическими инфарктами, апоплексией, очаговым тромбозом межворсинчатого пространства, плацентарной гипертензией и повышенным отложение фибрина в зонах некроза базальной пластинки и эпителия ворсин составляют структурную основу хронической плацентарной недостаточности, которая обуславливает рождение детей в состоянии тяжелой асфиксии, формирование задержки внутриутробного развития, перинатальной патологии ЦНС.
Рецензенты:Перетятко Л.П., д.м.н., профессор, заведующая лаборатории патоморфологии и электронной микроскопии Федерального государственного бюджетного учреждения "Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова" Министерства здравоохранения Российской Федерации, г. Иваново;
Борзова Н.Ю., д.м.н., профессор, главный научный сотрудник отдела акушерства и гинекологии Федерального государственного бюджетного учреждения "Ивановский научно-исследовательский институт материнства и детства имени В.Н. Городкова" Министерства здравоохранения Российской Федерации, г. Иваново.



