Общеизвестно,что печень характеризуется высокой чувствительностью к стрессорным воздействиям различной природы. Учитывая важнейшую роль этого органа в жизнеобеспечении организма, постстрессорные нарушенияфункций печени могут быть как основным проявлением соматической патологии, так и усугублять тяжесть других сопутствующих заболеваний [9].
Главными факторами, ведущими к формированию соматической патологии при ПТСР, в настоящее считаются изменения нейроэндокринного статуса, неизбежно сопровождающиеся активацией свободнорадикального окисления (СРО).Поэтому изучение окислительного стресса какфактора, вовлеченного в патогенез различных нервно-психических заболеваний и их осложнений – одна из наиболее актуальных проблем медицинской биохимии. Между тем, к настоящему моменту основные проявления окислительного стресса в печени при ПТСР до сих пор не изучены.
Цель исследования: характеристика основных проявлений окислительного стресса в печени при экспериментальном моделировании ПТСР.
Материалы и методы
Исследование выполнено на40 белых беспородных лабораторных крысах. Посттравматические стрессовые расстройства моделировали путем содержания животных в условиях длительного постоянного и неизбегаемого воздействия сильного безусловного раздражителя [5]. Контрольную группу составили интактные животные, не подвергавшиеся стрессорным воздействиям (n=16). Для оценки динамики формирования окислительного стресса сформировано три опытных группы. Продолжительность воздействия для всех групп составляла 10 суток. Первая опытная группа после завершения воздействия стрессора содержалась в обычных условияхв течение3 суток (n=8), вторая - 10 суток (n=8), третья - 14 суток (n=8).
В гомогенатахпечени определялисодержание первичных, вторичных и конечных молекулярных продуктов ПОЛ, а также уровень спонтанной и металл - катализируемой окислительной модификации белков (ОМБ) [1,2]. Все исследования были проведены одномоментно. Поведенческие реакции животных изучались с использованием теста «приподнятый крестообразный лабиринт» [4].
Результаты обработаны методами вариационной статистики и выражены в виде средней арифметической и ее стандартной ошибки (M±m). Оценка статистической значимости различий осуществлялась с помощью непараметрического критерия Манна-Уитни.Статистические взаимосвязи изучали при помощи непараметрического корреляционного анализа, выполняя расчёт коэффициентов корреляции рангов по Спирмену (Rs). Статистические различия считались значимыми при р<0,05.
Результаты и обсуждение
Результаты исследования представлены в таблице. На третьи сутки после завершения стрессорного воздействия было выявлено одновременное усиление липопероксидации и ОМБ в печени. При этом, наиболее выраженным был прирост содержания вторичных гептан-и изопропанол-растворимых продуктов ПОЛ (кетодиены и сопряженные триены), а также уровня карбонилированных белков.Это происходило на фоне уменьшения содержания изопропанол-растворимых диеновых конъюгатов в ответ на индукцию ПОЛ invitro. Известно, что мощность антиоксидантной защиты клетки определяется уровнем окисляемости, отражающим «экранирование» ненасыщенных связей в липидах [2]. Поэтому факт ограниченияFe+2/аскорбат - индуцированного ПОЛ в данном случае можно трактовать как снижение эффективности антиоксидантных систем.
В ходе ряда патологических состояний окислительный стресс сочетается с карбонильным, возникающим в результате увеличения концентрации активных соединений, содержащих альдегидные и карбонильные группы.Активными карбонильными соединениями являются вторичные продукты ПОЛ, возникающие при перекисном окислении липидов. Карбонильные продукты образуются также при свободнорадикальном окислении белков[8]. Вышеперечисленные соединения модифицируют аминокислотные остатки белков и азотистые основания нуклеиновых кислот, меняя свойства этих важнейших биомолекул. Карбонильный стресс в настоящее время считается наиболее тяжелым проявлением оксидативного стресса, приводящим к инициации воспаления, аутоиммунных повреждений, гибели клетки (апоптоз или некроз) [6].
Изменения содержания продуктов свободнорадикального окисления в гомогенатах печени крыс на различных сроках экспериментального моделирования ПТСР
|
Показатель |
Контроль (n=16) |
3 суток после завершения воздействий (n=8) |
10 суток после завершения воздействий (n=8) |
14 суток после завершения воздействий (ПТСР) (n=8) |
|
Диеновые конъюгаты (гептановая фаза) |
0,979±0,008 |
0,839±0,033 * |
0,971±0,006 |
1,015±0,005 * |
|
Кетодиены и сопряжённые триены (гептановая фаза) |
0,211±0,018 |
0,361±0,044 * |
0,243±0,037 |
0,207±0,022 |
|
Шиффовы основания (гептановая фаза) |
0,020±0,002 |
0,011±0,001 |
0,025±0,002 |
0,028±0,002 * |
|
Диеновые конъюгаты (изопропанольная фаза) |
0,386±0,027 |
0,485±0,013 * |
0,331±0,029 |
0,257±0,013 * |
|
Кетодиены и сопряжённые триены (изопропанольная фаза) |
0,176±0,012 |
0,233±0,008 * |
0,153±0,019 |
0,160±0,007 |
|
Диеновые конъюгаты (изопропанольная фаза, индукция Fe2+/ аскорбат) |
2,822±0,220 |
2,031±0,049 * |
3,197±0,246 |
4,135±0,245 * |
|
Кетодиены и сопряжённые триены (изопропанольная фаза, индукция Fe2+/ аскорбат) |
4,970±0,544 |
4,269±0,265 |
5,888±1,085 |
5,575±0,374 |
|
Карбонилированные белки,мкмоль/ г белка (индукция Fe2+ /H2O2) |
7,547±1,205 |
24,510±6,257 * |
6,909±1,007 |
11,09±4,850 |
|
Карбонилированные белки,мкмоль/ г белка (индукция Fe2+ /H2O2) |
56,647±2,020 |
55,299±4,791 |
47,569±2,059 * |
56,922±3,753 |
|
* - статистически значимые отличия от контрольной группы; е.о.и. – единицы окислительного индекса |
||||
Отличительной особенностью окислительного стресса в печени через 10 суток после завершения стрессорных воздействий было полное восстановление до уровней контрольных значений, как процессов ПОЛ, так и окислительной модификации белков.
Через 14 суток после завершения воздействия стрессора выявлено увеличение содержания гептан-растворимых продуктов ПОЛ при одновременном снижении содержания изопропанол-растворимых продуктов. В данном случае не исключено усиление активности фосфолипазы А2, которая, осуществляя гидролиз мембранных фосфолипидов, фактически уменьшает количество полярных субстратов (изопропанол - растворимые фосфолипиды) для переокисления, увеличивая при этом содержание неполярных (гептан-растворимых) субстратов – свободных жирных кислот.
Это происходило на фоне увеличения содержания изопропанол-растворимых первичных продуктов ПОЛ в ответ на индукцию (Fe2+/ аскорбат), что свидетельствует о возрастании эффективности липофильных антиоксидантов. Тем не менее, изменения подобного рода следует интерпретировать как достаточно выраженный окислительный стресс. Следует обратить внимание на очевидную тенденцию к повторному усилению карбонилирования белков при одновременном статистически значимом увеличении содержания шиффовых оснований.
Нейроэтологическое тестирование
животных через 14 суток после завершения стрессорных воздействий выявило усиление
интенсивностигруминга, снижение времени, проведённом в центре крестообразного лабиринта,
угнетение двигательной активности
(рис.).
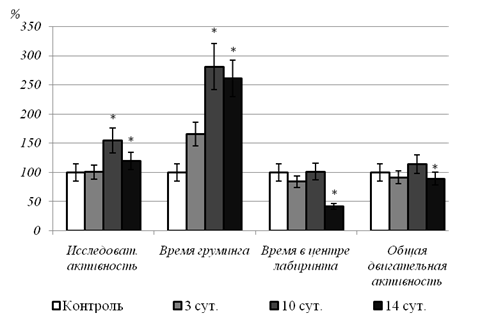
Рис. Изменения поведенческой активности крыс при экспериментальном моделировании ПТСР. Данные представлены в процентах от соответствующих показателей контрольной группы (100%) * - статистически значимые отличия от контроля
Таким образом, даже спустя достаточно длительное время после завершения стрессорных воздействий, то есть после двухнедельного содержания животных в обычных условиях, сохранялись поведенческие расстройства тревожного характера, что является атрибутивным признаком ПТСР.
Не исключено, что активация свободнорадикального окисления в печени могла повлечь за собой дисфункцию органа с последующим высвобождением продуктов окисления в кровоток и проявлению токсических эффектов интермедиатов СРО на системном уровне. Данное предположение базируется на наличии корреляционных взаимосвязей между содержанием продуктов СРО в гомогенатах печени и некоторыми нейроэтологическими параметрами в опытной группе животных через 14 суток после завершения воздействия стрессора. Уровень исследовательской активности (количество выглядываний животного за пределы лабиринта) имел обратную взаимосвязь с содержанием в печени вторичных гептан-растворимых (R=-0,87; P=0,005) и первичных изопропанол-растворимых (R=-0,94; P=0,001) продуктов ПОЛ, и прямую – с уровнем ПОЛ в ответ на индукцию Fe2+/аскорбат (R=0,91; P=0,002). Суммарная продолжительность актов груминга была напрямую связана с содержанием первичных изопропанол-растворимых (R=0,78; P=0,021) и вторичных гептан-растворимых (R=0,88; P=0,004) продуктов ПОЛ в печени животных. Следует также отметить наличие корреляционных взаимосвязей между индексом тревожности и уровнем окислительной модификации белков в печени (R=0,88; P=0,004).
Заключение
Таким образом, в динамике экспериментального моделирования посттравматического стрессового расстройства в печени наблюдаются изменения содержания продуктов СРО. На ранних этапах формирования ПТСР основным проявлением окислительного стресса является одновременное усиление карбонилирования белкови накопление вторичных продуктов ПОЛ, что соответствует состоянию так называемого карбонильного стресса. На более поздних сроках (10 суток после завершения воздействия) выявлено одновременное ограничение липопероксидации и ОМБ с восстановлением до контрольных значений.
Через 14 суток после завершения воздействия стрессора, к моменту формирования устойчивых поведенческих расстройств, характерных для ПТСР, также выявлены признаки окислительного стресса: наблюдалось одновременное увеличение содержания в печени гептан-растворимых первичных (диеновые конъюгаты), конечных (основания Шиффа) продуктов ПОЛ и уровня карбонилированных белков. Известно, что шиффовы основания образуются в процессе реакции продуктов ПОЛ и ОМБ альдегидной природы с аминогруппами, что приводит к образованию меж- и внутримолекулярных сшивокв молекулах протеинов[10].Поэтому, высокий уровень шиффовых оснований в данном случае свидетельствует в пользу усиления окислительной модификации белков. Это предположение подтверждается наличием корреляционных взаимосвязей между уровнем гептан-растворимых шиффовых оснований и уровнем металл - катализируемой ОМБ (Rs= 0,8, Р=0,014). Таким образом, основным проявлением окислительного стресса в печени при экспериментальном моделировании ПТСР является усиление окислительной модификации белков.
Рецензенты:Волчегорский И.А., д.м.н., профессор, заведующий кафедрой фармакологии ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава РФ, г. Челябинск;
Рябинин В.Е., д.б.н., профессор, профессор кафедры биологической химии ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава РФ, г. Челябинск.



