Триоксохроматы(+3) РЗЭ являются инертными соединениями с высокими температурами плавления 2300-2500 ºС [9]. Активированный кальцием триоксохромат(+3) лантана используется для производства высокотемпературных керамических электронагревателей, создающих рабочие температуры до 1600-1700 ºС, а триоксохроматы(+3) некоторых РЗЭ используются как антикоррозионные защитные покрытия на изделиях из оксидной керамики [5, 9, 14-16]. Термодинамические свойства триоксохроматов(+3) РЗЭ [1-4, 7-11, 12, 13, 17, 19, 21] изучены недостаточно из-за трудностей экспериментального характера и имеются значительные расхождения в величинах стандартных энтальпий образования, определенных методом ЭДС.
Высокотемпературная энтальпия триоксохроматов(+3) La, Ce, Nd, Gd и Y измерена в интервале 300-1000 K , а для триоксохроматов(+3) Dy, Ho и Yb – в интервале 390-1500 ºС. Низкотемпературная теплоемкость определена для триоксохроматов(+3) лантана, иттрия, неодима и самария, что позволило авторам рассчитать стандартную энтропию этих соединений. Изучены высокотемпературные термодинамические свойства YCrO3 [7, 17, 21], по эмпирической формуле на основании правила аддитивности оценена стандартная энтропия триоксохроматов(+3) лантана, иттрия и скандия [1]. Приведенные сведения недостаточны для оптимизации процессов, связанных с эксплуатацией высокотемпературных материалов на основе искомых триоксо-хроматов(+3) РЗЭ. Поэтому в данной работе применены некоторые расчетные методы для расширения знаний по термодинамике триоксохроматов(+3) РЗЭ.
Основная часть
С этой целью опубликованные экспериментальные значения высокотемпературных энтальпий Нт – Н298 в данной работе обработаны по единой методике на основе уравнения вида Ср = А + 2ВТ – СТ-2 и приведены в табл. 1 и на рис. 1, 2. Поскольку температурная зависимость теплоёмкости YCrO3 изучена в двух работах [4, 11] , проведена совместная обработка этих величин как равноточных, т.к. синтез и методика исследования триоксохромата(+3) иттрия были в обеих работах идентичны. Таким образом, температурная зависимость теплоемкости триоксохромата(+3) иттрия является наиболее надежной и поэтому использована как базовая для сопоставлений с аналогичными зависимостями для триоксохроматов(+3) других РЗЭ с целью расширения температурных интервалов последних. На основании одного из методов сравнительного расчета [20] получена линейная взаимосвязь между температурной зависимостью теплоёмкости триоксохромата(+3) иттрия и температурными зависимостями теплоёмкостей триоксохроматов(+3) La, Ce, Nd, Gd, Dy, Ho и Yb (рис. 3, 4), а для триоксохроматов(+3) La, Ce, Nd и Gd, кроме того, справочные данные расширены до 1800 К.
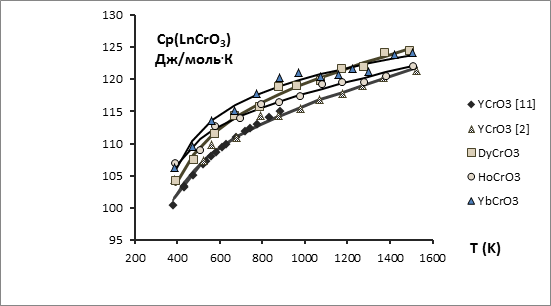
Рис. 1. Зависимость теплоемкости LnCrO3 от температуры
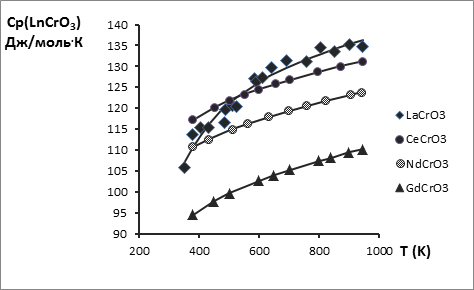
Рис. 2. Зависимость теплоемкости LnCrO3 от температуры
Таблица 1
Коэффициенты уравнения Ср = А + 2ВТ – СТ-2
|
Состав |
А |
В·103 |
С·10-5 |
∆Т, K |
|
YCrO3 |
107,8± 1,1 |
4,80 ±0,48 |
14,8 ±1,6 |
298-1524 |
|
LaCrO3 |
125,0±5,4 |
7,70±3,00 |
28,80±5,32 |
350-945 |
|
CeCrO3 |
118,4±0,4 |
7,43±0,23 |
9,92±0,47 |
379-945 |
|
NdCrO3 |
109,8±0,7 |
7,91±0,38 |
7,52±0,76 |
379-940 |
|
GdCrO3 |
95,4±0,5 |
8,53±0,25 |
10,47±0,51 |
378-945 |
|
DyCrO3 |
111,9±1,4 |
4,59±0,53 |
17,88±2,0 |
298-1492 |
|
HoCrO3 |
112,0±1,6 |
3,50±0,63 |
12,64±2,47 |
298-1504 |
|
YbCrO3 |
117,1±1,7 |
2,50±0,67 |
20,17±2,63 |
298-1508 |
Уравнения взаимосвязи, приведенные ниже, имеют в среднем коэффициент корреляции R2 ≥ 0,99.
Cp(LaCrO3) = 1,819 Cp(YCrO3) - 72,92; R2 = 0,999
Cp(CeCrO3) = 1,0119 Cp(YCrO3) + 14,172; R2 = 0,993
Cp(NdCrO3) = 0,9514 Cp(YCrO3) + 13,691; R2 = 0,988
Cp(GdCrO3) = 1,1261 Cp(YCrO3) - 19,997; R2 = 0,993
Cp(DyCrO3) = 1,0661 Cp(YCrO3) - 4,3871; R2 = 0,999
Cp(HoCrO3) = 0,7827 Cp(YCrO3) + 27,019; R2 = 0,999
Cp(YbCrO3) = 0,8873 Cp(YCrO3) + 16,844; R2 = 0,984
Сp(YCrO3) = 0,894 Cp(Y2O3) + 1,740 ; R2 = 0,9961
Cp(YCrO3) = 0,988 Cp(Cr2O3) 9,984 ; R2 = 0,9998
Cp(YCrO3) = 0,934 (Cp(Y2O3) +Cp(Cr2O3)/2) 3,2686 ; R2 = 0,9986
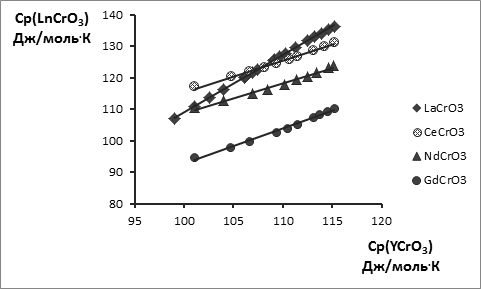
Рис. 3. Взаимосвязь теплоёмкости LnCrO3 и теплоёмкости YCrO3
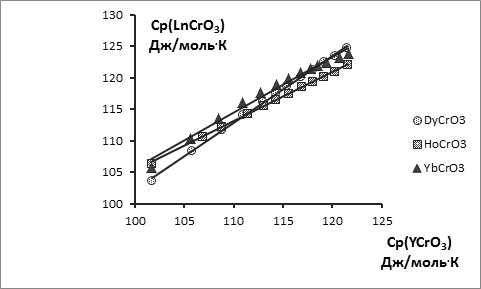
Рис. 4. Взаимосвязь теплоёмкости LnCrO3 и теплоёмкости YCrO3
Линейная корреляция реализуется также и в случае использования в качестве базового соединения оксида соответствующего РЗЭ или суммы исходных оксидов (рис. 5), при этом наличие полиморфных превращений у оксидов РЗЭ и, соответственно, изменение значений теплоёмкости в области фазового перехода, практически не ухудшает коэффициент корреляции благодаря малости указанных величин (изменение теплоёмкости для оксидов некоторых РЗЭ составляет 1-3Дж/моль ·К).
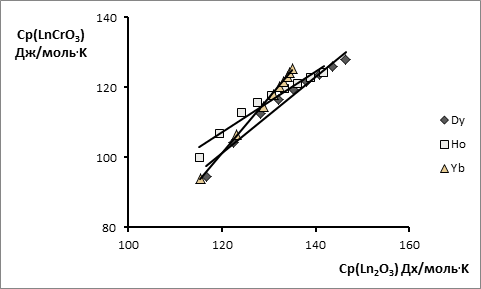
Рис. 5. Взаимосвязь теплоемкости LnCrO3 и теплоёмкости Ln2O3 в интервале температур 298-1524 K
Авторами исследований низкотемпературной теплоёмкости в интервалах 80-298, 5-300 и 55-300К [4, 8, 11, 17] были рассчитаны стандартные энтропии триоксохроматов(+3) РЗЭ, которые совместно с теплоёмкостью Ср,298 , приведены в табл. 2.
Таблица 2
Теплоёмкость и стандартная энтропия LnCrO3 (Дж/моль·К)
|
Состав |
Ср,298 |
Sºf,298 |
Состав |
Ср,298 |
Sºf,298 |
|
LaCrO3 |
107,9 |
109,6 ±2,5 109,2±0,3* |
DyCrO3 |
116,7 |
|
|
СeCrO3 |
101,1 |
|
HoCrO3 |
115,2 |
|
|
NdCrO3 |
111,2 |
106,8±0,3* |
YCrO3 |
104,9 |
96,4 90,6±0,2 |
|
GdCrO3 |
106,7 |
|
YbCrO3 |
115,4 |
|
|
SmCrO3 |
106,6 |
108,9±0,3* |
|
|
|
* S298 - S55
Поскольку в работе [8] низкотемпературная теплоёмкость измерена в интервале 55-300 К, следовательно, значения энтропии, приведенные в табл. 2, занижены на величину S55 – S0., которая по данным для YCrO3 составляет ≈ 6 Дж/моль К. Поэтому корректные значения энтропии для NdCrO3 и SmCrO3 должны быть увеличены.
Приведенные в некоторых публикациях эмпирические формулы для оценки стандартной энтропии твердых кристаллических соединений [10, 22] основаны на использовании энтропии базового соединения, в частности, триоксохромата(+3) РЗЭ или оксидов, из которых образован искомый триоксохромат(+3) РЗЭ. Результаты расчётов по ним приведены в табл. 3.
![]() =
= ![]() + 1,5n1 R ln
+ 1,5n1 R ln![]() + 1,5n2 R ln
+ 1,5n2 R ln![]() (1),
(1),
где n1 =n2 = 1моль ; M ![]() молярная масса, г/моль;
молярная масса, г/моль;
V – молярный объем, л/моль
![]() = n1
= n1 ![]() + n2
+ n2 ![]() (2),
(2),
где n1 = n2 = 0,5 ; d – плотность, г⁄ см3
Другим методом оценки энтропии является эмпирическое уравнение (3) зависимости энтропии соединения от суммы значений электронных слоев(ΣN) у атомов, образующих это соединение [21]. Выражение вида
![]() =12,419·ΣN - 96,363 R2 = 0,992 (3)
=12,419·ΣN - 96,363 R2 = 0,992 (3)
получено с использованием энтропии оксидов лантана, иттрия, скандия, лютеция и хрома (3); результаты расчетов стандартной энтропии триоксохроматов(+3) РЗЭ по уравнению 3 согласуются с наиболее надежными значениями энтропии для триоксохроматов(+3) иттрия и лантана в пределах 7-9% .
Таблица 3
Стандартная энтропия LnCrO3 (Дж/моль К) по данным эмпирических расчетов
|
Состав |
So298(1) |
So298(2) |
So298(3) |
Состав |
So298(1) |
So298(2) |
|
ScCrO3 |
|
82,4 |
77,5 |
GdCrO3 |
100,8 |
111,3 |
|
YCrO3 |
|
86,4 |
89,9 |
DyCrO3 |
100,5 |
110,4 |
|
LaCrO3 |
100,0 |
100,8 |
102,3 |
HoCrO3 |
100,4 |
116,4 |
|
СeCrO3 |
|
108,4* |
|
YbCrO3 |
100,5 |
104,0 |
|
NdCrO3 |
99,9 |
115,1 |
|
LuCrO3 |
100,6 |
|
* оценка по данным [17]
Поэтому эти величины совместно с результатами экспериментальных измерений использованы в данной работе для расчетов других термодинамических характеристик по известному термодинамическому соотношению ∆G = ∆Н - Т∆S и справочным данным из [6].
Рекомендуемые значения термодинамических свойств триоксо-хроматов(+3) РЗЭ приведены в таблице 4 (Sºf,298 – стандартная энтропия образования, ∆Hºf,298 – стандартная энтальпия образования).
Таблица 4
Термодинамические свойства LnCrO3 некоторых РЗЭ
|
Состав |
Cp,298 Дж/моль К |
Sºf,298 Дж/моль К |
∆Sºf,298 Дж/моль К |
∆Hºf,298 кДж/моль |
∆Gºf,298 кДж/моль |
|
LaCrO3 |
107,9 |
109,6 |
279,9 |
1591± 10 |
1507 |
|
YCrO3 |
104,9 |
96,4 |
280,6 |
1563 ±11 |
1479 |
|
ScCrO3 |
- |
77,5 |
289,8 |
- |
- |
|
CeCrO3 |
101,1 |
119,7 |
295,8 |
1532±20 |
1443 |
|
NdCrO3 |
111,2 |
107 |
297,4 |
- |
- |
|
SmCrO3 |
106,6 |
109 |
293,2 |
- |
- |
|
DyCrO3 |
116,7 |
110 |
- |
1541±11 |
1455* |
|
HoCrO3 |
115,2 |
116 |
- |
1540±8 |
1454* |
|
LuCrO3 |
- |
102,3 |
- |
- |
- |
* расчёт по ∆Sср = 288
Выводы
На основании анализа собственных и литературных значений высокотемпературной зависимости теплоёмкости триоксохроматов(+3) LnCrO3 расширены сведения по теплоёмкости этих соединений до 2000K. С помощью эмпирических формул (1-3) оценена ∆Sºf,298 триоксохроматов(+3) LnCrO3 ряда РЗЭ и рассчитана стандартная энергия Гиббса образования искомых соединений.
Рецензенты:
Василев В.А., д.х.н., профессор, РХТУ им. Д.И. Менделеева, г. Москва;
Кузнецов В.В. , д.х.н., ведущий научный сотрудник, РХТУ им. Д.И. Менделеева, г. Москва.



