Последние два десятилетия в качестве одного из ведущих механизмов патогенеза, течения и прогноза инфаркта миокарда (ИМ) рассматривается системное воспаление (СВ) [8]. Ключевым звеном СВ является системная воспалительная реакция (СВР), которая определяется как накопление в кровотоке медиаторов воспаления и других продуктов клеточного стресса в ответ на действие повреждающих факторов [3]. Поскольку начальные организующие механизмы воспаления имеют исключительное значение в последующем течении и исходах ИМ, оценка интенсивности СВР необходима уже в первые часы после поступления больного в клинику. Учитывая широкую распространенность коморбидной патологии у больных ИМ, важно определить значимость «фонового» хронического воспаления в развитии системного воспалительного ответа на ишемическое повреждение миокарда на разных стадиях заболевания – в остром, подостром периоде и отдаленной перспективе.
Наиболее часто сочетающимися заболеваниями при ИМ являются артериальная гипертензия (АГ), сахарный диабет 2 типа (СД2) и хроническая обструктивная болезнь легких (ХОБЛ). При подборе адекватной терапии больным с коморбидной патологией могут возникать определенные трудности, связанные с повышением риска побочных эффектов и нежелательного взаимодействия препаратов. Проведенные исследования подтверждают отягощающее влияние сопутствующих СД2, ХОБЛ и анемии на течение и прогноз ИМ [2, 4, 6, 7]. В основе взаимного отягощения ИМ и ряда сопутствующих заболеваний лежит общность многих факторов риска и звеньев патогенеза, включая микроциркуляторные расстройства и иммуновоспалительные сдвиги, которые могут влиять на выраженность СВР. Однако сведения о механизмах такого влияния единичны, а иногда противоречивы. В качестве лабораторных маркеров СВР в большинстве исследований используются С-реактивный белок, интерлейкины ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10, фактор некроза опухолей альфа (ФНО-α). При этом существуют проблемы, ограничивающие использование указанных маркеров в клинической практике. В их числе нестабильность уровней цитокинов в крови, хаотичность их изменения и слабая корреляцией между собой [3].
Диагностическая значимость оценки уровня цитокинов в клинической практике в настоящее время заключается в констатации самого факта его повышения или понижения у данного больного. Прогностическая ценность ряда используемых маркеров воспаления зависит от проведения реперфузионной терапии и сроков забора крови. Нет четкого представления о том, какие маркеры и на какой стадии ИМ наиболее адекватно отражают интенсивность процесса воспаления. Не существует разработок, позволяющих дифференцировать замедленное – гипореактивное и чрезмерно интенсивное – гиперреактивное течение воспалительной реакции в остром периоде ИМ. В этой связи актуальной проблемой кардиологии продолжает оставаться поиск маркеров воспаления, являющихся независимыми предикторами течения и прогноза ОИМ.
Выраженность воспаления и темпы его развития зависят от резистентности и реактивности организма, которые формируют гипо-, нормо- и гиперреактивные типы СВР. При адекватном заболеванию нормореактивном типе СВР у больных ИМ наблюдается согласованное по срокам развития и интенсивности протекание некротических и репаративных процессов. Разобщение в их течении при гипо- и гиперреактивном типах СВР приводит к снижению прочности стенки сердца в зоне инфаркта, чем создаются условия для развития послеинфарктных осложнений [5]. В качестве ориентировочных маркеров оценки выраженности воспалительной реакции могут быть использованы индексы соотношения популяций лейкоцитов периферической крови.
Целью исследования является оценка выраженности системной воспалительной реакции и тяжести течения ОИМ у пациентов с сопутствующей патологией: СД2, ХОБЛ, язвенной болезнью (ЯБ) желудка и двенадцатиперстной кишки, анемическим синдромом (АС).
Материал и методы. Обследовано 499 больных острым инфарктом миокарда, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ) ГБУЗ СО «Самарская медсанчасть № 2» за период с февраля 2008 г. по ноябрь 2012 г., в том числе 113 пациентов с летальным исходом ИМ. Средний возраст обследованных пациентов с ОИМ 68,2±10,5 года, мужчины составляют 50,1%. ИМ с зубцом Q диагностирован в 60,5% случаев. У 59,5% больных некроз локализован в передней и переднебоковой стенках левого желудочка. Диагностика и лечение больных проводились в соответствии с действующими рекомендациями (ВНОК 2007 г., ЕОК/АКК 2009 г.). Системный тромболизис использовался в качестве самостоятельной реперфузионной стратегии. Методы современной интервенционной кардиоангиологии и хирургического лечения к обследованным пациентам не применялись. Тромболитическая терапия проведена 194 больным ИМ с подъемом сегмента ST ЭКГ (38,9%).
Исследовательский массив сформирован на основе простого случайного отбора. Критерием исключения служило наличие злокачественных новообразований, острых воспалительных и обострение хронических заболеваний, применение глюкокортикоидов и нестероидных противовоспалительных препаратов. Статистический анализ данных проводился на основе пакета SPSS 11.0. Достоверность различий среднегрупповых показателей определялась с использованием критериев Манна-Уитни и хи-квадрат. Корреляционный анализ проводился по критерию Спирмена. При нормальном распределении данные представлены как среднее значение и стандартное отклонение (M±SD), при распределении отличном от нормального – в виде медианы и интеркваритльного размаха. Различия считали статистически значимыми при p<0,05.
Интенсивность системной воспалительной реакции на ишемическое повреждение миокарда оценивалась по интегральным лейкоцитарным показателям – относительному содержанию клеток в лейкоцитарной формуле общего анализа крови, забранного в первый час госпитализации. Контрольную группу для расчета референтных значений лейкоцитарных индексов, аналогичную по полу и возрасту, составили 508 практически здоровых лиц.
По новейшим данным системное воспаление при ИМ непосредственно связано с активацией нейтрофилов, которые проявляются в периферической крови в первые часы после начала острых симптомов [9]. В соответствии с этим в исследовании использованы следующие лейкоцитарные индексы: индекс сдвига лейкоцитов крови (ИСЛК) – отношение гранулоцитов к агранулоцитам; соотношение клеток неспецифической (нейтрофилы) и специфической (лимфоциты) защиты (ИСНЛ); лейкоцитарный индекс интоксикации (ЛИИ) – отношение уровня нейтрофильных лейкоцитов к клеткам центрального (лимфоциты) и периферического (моноциты, эозинофилы, базофилы) звеньев иммуногенеза.
По результатам выполненных расчетов значения лейкоцитарных индексов в контрольной группе, в группах больных ИМ с зубцом Q, не Q-ИМ и группе с фатальным исходом статистически значимо (p<0,001) различаются, что свидетельствует об объективном отражении тяжести течения ИМ (табл. 1).
Таблица 1
Изменение значений интегральных лейкоцитарных показателей в зависимости от тяжести течения инфаркта миокарда
|
Показатели |
Контрольная группа n=508 |
ИМ без зубца Q n=197 |
ИМ с зубцом Q n=302 |
Фатальный ИМ n=113 |
|
ИСЛК |
1,6±0,4 |
2,6±1,4* |
3,2±2,0* |
3,9±2,4* |
|
ИСНЛ |
2,0±0,5 |
3,1±2,4* |
3,2±3,3 |
4,9±3,9* |
|
ЛИИ |
0,7±0,3 |
1,9±1,7* |
2,5±2,0* |
3,2±2,3* |
|
Лейкоциты |
6,3±1,2 |
8,0±3,0* |
9,2±3,8* |
10,4±4,1* |
Примечание: * - p<0,001 по сравнению с предыдущей группой.
Корреляционный анализ выявил сильную взаимосвязь значений лейкоцитарных индексов: ИСЛК и ИСНЛ rs = 0,98 (р<0,001), ИСЛК и ЛИИ rs = 0,72 (р<0,01), ИСНЛ и ЛИИ rs=0,73 (р<0,01), что позволяет в дальнейшем анализе использовать один из показателей.
Установлены клинически значимые пороговые уровни индексов, характеризующие тип СВР. Так, значения ИСЛК, соответствующие среднестатистическим показателям здоровых людей, при установленном клиническом диагнозе ОИМ свидетельствуют об иммунной арективности пациента и гипореактивном течении СВР: ИСЛК ≤ 1,8. Нормореактивное течение воспалительного процесса, который обеспечивает формирование полноценного рубца и неосложненное заживление ИМ отмечено при показателях 1,9-2,7. Значения ИСЛК >2,7 свидетельствуют о гиперреактивном течении СВР.
Для оценки тяжести течения, прогноза ОИМ и типа СВР пациенты разделены на 6 групп: группа сравнения «А» – больные ИМ и АГ без других сопутствующих заболеваний, группа пациентов с множественной патологией помимо АГ (2 и более) и четыре группы с сопутствующими СД2, ХОБЛ, ЯБ и АС.
Результаты и обсуждение. Практически у всех обследованных больных – 94% ОИМ развился на фоне артериальной гипертонии, что не позволяет исключить влияние данного фактора на клиническое течение заболевания или в сравнительном аспекте оценить его наряду с другими сопутствующими заболеваниями. В связи с этим больные с ОИМ и АГ объединены в группу сравнения «А». Общая клиническая характеристика больных с коморбидной патологией и в группе сравнения приведена в таблице 2.
Таблица 2
Сравнительные клинические характеристики больных ОИМ с сопутствующей патологией и без неё, M±SD, n (%)
|
Показатель |
Группа сравнения «А» (ОИМ и АГ) |
Сопутствующие заболевания |
||||
|
СД 2 типа |
ХОБЛ |
ЯБ |
Анемия |
2 и более |
||
|
Обследовано |
258 (51,7) |
76 (15,2) |
43 (8,6) |
20 (4) |
53 (10,6) |
49 (9,8) |
|
Возраст, лет |
66,8±11,0 |
68,8±8,9 |
71,0±9,8 |
65,8±9,4 |
73,1±10,0 |
68,2±10,0 |
|
Женщины |
104 (40,3) |
55 (72,4) |
10 (23,3) |
8 (40) |
38 (71,7) |
34 (69,4) |
|
ИМ с Q |
160 (62) |
47 (61,8) |
28 (65,1) |
14 (70) |
28 (52,8) |
25 (51) |
|
Повторный ИМ |
81 (31,4) |
27 (35,5) |
14 (32,6) |
8 (40) |
15 (28,3) |
23 (46,9) |
|
Тромболизис |
111(43) |
35(46) |
12(27,9) |
12(60) |
12 (22,6) |
17(34,7) |
|
ФК по NYHA III-IV |
163 (63,2) |
54 (71,1) |
29 (67,4) |
13 (65) |
41 (77,4) |
38 (77,6) |
|
ФВ ЛЖ, % |
55,7±10,8 |
52,3±12,2 |
54,5±10,9 |
57,2±10,6 |
55,3±11,1 |
52±11,6 |
|
Отек легких |
43 (16,7) |
21 (27,6) |
11 (25,6) |
2 (10) |
13 (24,5) |
17 (34,7) |
|
Шок |
33 (12,8) |
12 (15,8) |
10 (23,3) |
2 (10) |
11 (20,8) |
10 (20,4) |
|
Аневризма |
37 (14,3) |
16 (21,1) |
4 ( 9,3) |
4 (20) |
5 (9,4) |
5 (10,2) |
|
Фатальный ИМ |
51 (19,8) |
17 (22,4) |
14 (32,6) |
2 (10) |
17 (32,1) |
12 (24,5) |
|
Лейкоциты |
9,3±4,0 |
9,3±3,4 |
8,4±3,1 |
9,3±5,1 |
8,6±3 |
8,9±3,5 |
|
ИСЛК |
3,2±2,0 |
3,1±2,2 |
2,8±1,5 |
3,6±2,9 |
2,9±1,6 |
3,2±1,9 |
|
ИСНЛ |
4±3,6 |
3,6±2,8 |
3,3±2,2 |
4,3±3,9 |
3,7±3 |
3,9±2,5 |
|
ЛИИ |
2,6±2,1 |
2,4±1,7 |
1,8±1,5 |
2,8±2,4 |
2,3±2,2 |
2,4±2 |
В целом по выборке коморбидность составила 48,3%. Средний возраст больных ОИМ с коморбидной отягощенностью и без нее соответственно 70,0±9,7 и 66,7±11,0 лет (p<0,05). Доля пациентов с 2-мя и более формами сочетанной (множественной) патологии составляет около 10%. В эту группу входят 49 пациентов, большинство которых – 34 чел. (69%), наряду с такими нозологическими формами, как ХОБЛ, АС, ЯБ, в анамнезе имеют сахарный диабет, что и определяет клинические особенности течения ОИМ.
Данные о распространенности сопутствующих заболеваний у больных ОИМ, включенных в исследование, согласуются с представленными в литературе. В целом доля пациентов с ОИМ в сочетании с СД2 составила 22%. В их числе более 73% женщин старше 65 лет. По данным мультинациональных регистров GRACE, OASIS и EHS-ACS от 19 до 23% пациентов с ОИМ имели ранее диагностированный СД. Сведений о распространенности ХОБЛ у больных ОИМ в доступной литературе найти не удалось. Сочетание ИМ и ХОБЛ выявлено у 13% обследованных, что в 1,3 больше доли больных ХОБЛ в популяции лиц старше 40 лет. По эпидемиологическим данным, само наличие ХОБЛ увеличивает риск ИМ в 1,4 раза [7]. В числе пациентов с ХОБЛ около 75% мужчин. Доля курильщиков составляет 33%, при этом в группе сравнения таких 19%. В группе пациентов с ИМ и сопутствующей язвенной болезнью (6,2%) также преобладают мужчины – 55%, средний возраст 61,8±8,6. У 17,4% обследованных пациентов выявлена анемия, что соответствует результатам недавних исследований [6]. В том числе 72% женщин старше 70 лет. Большинство (77%) случаев АС представлены анемией легкой степени тяжести с содержанием гемоглобина выше 90 и >110 г/л и 23% средней и тяжелой степени (70-90 и >70 г/л).
Как показал анализ, в группах больных ИМ с коморбидной патологией распространенность повторных инфарктов в среднем на 15% больше, при множественной патологии, в которой преобладает СД2 – на 49%. Частота ХСН III-IV функциональных классов по NYHA имеет тенденцию к увеличению при наличии сопутствующих заболеваний в среднем на 15-22% по сравнению с группой «А». По локализации ИМ и наличию зубца Q значимых различий между группами не установлено (p>0,05). Результаты эхокардиографического исследования не выявили статистически значимого увеличения конечного диастолического и конечного систолического размеров левого желудочка (ЛЖ), свидетельствующего о развитии дилатации ЛЖ у больных с коморбидной патологией.
У больных ОИМ в сочетании с СД2, а также в группе с множественной патологией выявлено статистически значимое увеличение частоты такого ургентного осложнения как отек легких (p<0,01), что соответствует данным литературы [4]. В целом по выборке у пациентов с ОИМ при наличии сопутствующей патологии в 1,5 раза больше распространенность отека легких и кардиогенного шока. При сочетании с ХОБЛ частота последнего достоверно увеличивается (p<0,05).
В группах с коморбидной патологией госпитальная смертность на 20% выше, чем в группе сравнения. Средняя продолжительность от момента госпитализации до времени смерти составляет 3 (1,5; 7) суток. При наличии анемии внутрибольничная летальность увеличивается более чем в 1,6 раза по сравнению с группой «А» (p=0,019). Полученные данные соответствуют результатам новейших исследований, которыми установлено, что наличие анемии при поступлении больного с ОКС является независимым предиктором госпитальной смертности [6].
Исследование зависимости риска госпитальной смертности в зависимости от интенсивности системного воспалительного ответа, оцениваемого по уровню лейкоцитарных индексов клеточной реактивности, показало достоверное увеличение риска фатального исхода ОИМ при увеличении значений ИСЛК. Значения лейкоцитарных индексов рассчитываются как соотношение различных форм лейкоцитов и не зависят от их общего количества. В последние годы получены данные, свидетельствующие, что высокий исходный уровень лейкоцитов в крови достоверно отражает вероятность развития кардиогенного шока, отека легких и увеличение смертности больных ИМ [1]. В связи с этим результаты оценки тяжести течения ОИМ и риска фатального исхода, полученные при использовании лейкоцитарных индексов, сравнивались с результатами оценок по уровню лейкоцитов. На рисунках 1 и 2 представлены результаты аппроксимации среднегрупповых пар значений ИСЛК, уровня лейкоцитов и доли умерших на госпитальном этапе.
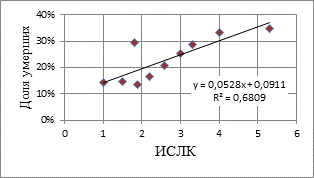
Рис.1. Зависимость риска летального исхода при ОИМ от уровня ИСЛК
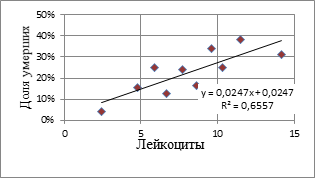
Рис. 2. Зависимость риска летального исхода при ОИМ от уровня лейкоцитов
На рис. 1 видно, что количество смертельных исходов на госпитальном этапе значительно увеличивается при значениях ИСЛК>2,7, которые определяют гиперреактивный воспалительный ответ. При гипореактивном типе СВР (значения ИСЛК<1,8) также отмечено увеличение доли умерших больных, по сравнению с нормореативным течением воспалительной реакции (ИСЛК 1,9-2,7). Полученное распределение и линия тренда на рис. 2 также свидетельствуют об увеличении риска смертельного исхода в зависимости уровня лейкоцитов и соответствуют данным литературы. Вместе с тем при оценке риска с использованием индекса соотношения гранулоцитов и агранулоцитов – ИСЛК получен больший коэффициент детерминации R2=0,68. Кроме того, в последние годы доказано, что в ранней фазе острого инфаркта миокарда только субпопуляция нейтрофилов массово активирована [9]. Учитывая данные факторы, использование ИСЛК для прогнозирования развития осложнений и смертности при ОИМ можно признать приоритетным.
Среднегрупповые значения лейкоцитарных индексов у больных ОИМ с коморбидной патологией и без нее не имеют статистически значимых различий (табл. 2). Соотношение гипо-, нормо- и гиперреактивных типов СВР в группах с сочетанной патологий представлено на рис. 3.
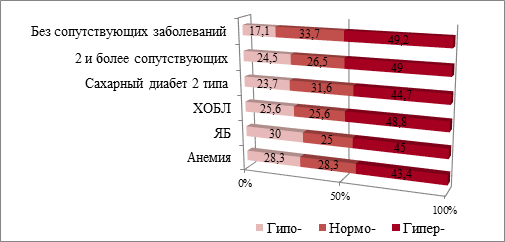
Рис. 3. Соотношение типов СВР в группах больных ОИМ с сопутствующей патологией
Как видно на рисунке, гиперреактивный тип СВР является преобладающим в остром периоде ОИМ независимо от наличия или отсутствия коморбидной патологии, частота выявления составляет от 43% до 49% случаев. Статистически значимых различий по критерию хи-квадрат в зависимости от типа СВР между группами с различными формами сочетанной патологии не выявлено: при сопутствующих СД2 p=0,769, ХОБЛ p=0,608, ЯБ p=0,749, анемии p=0,799.
Заключение. По результатам исследования, коморбидность больных ОИМ составила 48,3%. Наиболее распространенным сопутствующим заболеванием является сахарный диабет 2 типа – 22%. Наличие коморбидной патологии усиливает риск осложнений и неблагоприятных исходов ИМ. Частота таких ургентных осложнений, как отек легких и кардиогенный шок увеличивается в 1,5 раза. При сочетании ОИМ и СД2, а также в группе с множественной патологией выявлено статистически значимое увеличение частоты отека легких (p<0,01). При наличии ХОБЛ у больных ОИМ достоверно увеличивается частота кардиогенного шока (p<0,05). Уровень госпитальной смертности у больных ОИМ с различными формами коморбидной патологии в среднем на 20% выше, чем в группе без сопутствующих заболеваний. При наличии анемии госпитальная летальность статистически значимо увеличивается (p=0,019). В структуре причин внутрибольничной летальности независимо от наличия коморбидной патологии на первом месте острая сердечная недостаточность, которая проявлялась отеком легких, кардиогенным шоком или их сочетанием.
Наличие или отсутствие коморбидной патологии при ОИМ не является определяющим в формировании типа СВР. Не установлено синергизма действия одной или нескольких форм сопутствующей патологии на выраженность системной воспалительной реакции в остром периоде ИМ. Гиперреактивный тип системного воспаления при ОИМ является преобладающим. Интенсивная системная воспалительная реакция, проявляющаяся значительным повышением индекса сдвига лейкоцитов крови и лейкоцитозом, является предиктором летального исхода у больных острым инфарктом миокарда.
Рецензенты:
Симаков А.А., д.м.н., профессор, зам. главврача по лечебной работе ГБУЗ СО «Самарская медсанчасть № 2», г. Самара.
Зарубина Е.Г., д.м.н., профессор, руководитель научно-инновационного отдела НОУ ВПО «Медицинский институт «РЕАВИЗ», г. Самара.



