Заболевания пародонта представляют собой одну из важнейших проблем современной стоматологии. Высокая распространенность воспалительных заболеваний пародонта среди взрослого населения, наличие клинических форм, приводящих к разрушению зубо-челюстной системы и потере зубов, частота возникновения рецидивов заболевания диктует поиск оптимальных средств для лечения и профилактики воспалительных заболеваний пародонта. Лекарственные формы и лекарственные средства, используемые для местного лечения заболеваний пародонта, должны ликвидировать или уменьшить микроциркуляторные нарушения и связанные с ними воспалительно-деструктивные изменения в пародонтальных тканях; уменьшить отрицательное влияние микрофлоры зубодесневых карманов; устранить отек и экссудат; нормализовать тканевой обмен и способность ткани пародонта к регенерации. Для активной патогенетической терапии в клинической стоматологии успешно применяют лекарственные препараты, иммобилизованные на полимерных носителях – стоматологические лекарственные пленки.
Целью данной работы является разработка состава, технологии и методик анализа двухслойных стоматологических лекарственных пленок (СЛП), обладающих обезболивающим, противовоспалительным и антимикробным действием.
Материал и методика. Объектами исследований были выбраны: новокаин – применяется для местной анестезии, малотоксичен; норсульфазол-натрий (сульфатиазол) – оказывает бактериостатическое действие, активен в отношении грамположительных и грамотрицательных кокков, кишечной палочки и др.; сок каланхоэ – широко используется в стоматологической практике, оказывает противовоспалительное действие, способствует очищению ран от некротических тканей, стимулирует их заживление. Оптимальной лекарственной формой были избраны двухслойные СЛП, позволяющие сочетать лекарственные вещества с различным фармакологическим действием и несовместимые лекарственные вещества. Кроме того, двухслойные СЛП обеспечивают последовательность высвобождения действующих веществ и, что весьма важно, пролонгированное действие. В двухслойных пленках один слой включал новокаин, сок каланхоэ и натрия гидрокарбонат, а второй слой – норсульфазол натрия. На первоначальном этапе исследований осуществляли выбор полимеров для матриц-носителей лекарственных веществ, в качестве которых использовали метилцеллюлозу (МЦ), натрийкарбоксиметилцеллюлозу (Na-КМЦ), поливиниловый спирт (ПВС), желатин и их сочетания друг с другом. Модельные образцы готовили методом испарения растворителя из водных растворов полимеров различных концентраций. Анализ полученных пленок проводили по общепринятым показателям: эластичность, равномерность распределения поливочной массы по подложке, адгезия, толщина пленок. По результатам анализа были отобраны следующие составы полимерных матриц: 8% раствор желатина; 3% раствор МЦ; 3% раствор МЦ + 4% раствор полиэтиленоксида с М.м. 400; 4% раствор Na-КМЦ; 6% раствор ПВС. В качестве пластификатора использовали глицерин в различных концентрациях. Новокаин и норсульфазол вводили по 1,0 г на 100 г поливочной массы. Критерием оценки способности к высвобождению действующих веществ из пленок служат степень и скорость их высвобождения, которая позволяет получить информацию о возможном поведении лекарственных веществ в организме. Для этой цели использовали метод равновесного диализа через полупроницаемую мембрану. Средой для диализа служила вода очищенная.
Определение антимикробного действия изучаемых препаратов проводили методом диффузии в агар – способ «колодцев». Были использованы следующие тест-культуры микроорганизмов: 1.Staphyllococcus aureus (209); 2.Staphyllococcus aureus (Макаров); 3.Staphyllococcus aureus (Type); 4.Staphyllococcus epidermidis Wood-46; 5.Echerichia coli 675; 6.Salmonella gallinarum; 7.Bacillus subtilis L2; 8.Bacillus anthracoides – 16; 9.Proteus vulgaris.
Для идентификации новокаина и норсульфазола – натрия в СЛП использовали химические реакции. При выборе химических реакций было обращено внимание на простоту, скорость выполнения, достоверность полученных результатов, чувствительность реакций и взаимное влияние ингредиентов на результаты идентификации. Для идентификации новокаина использовали реакцию образования азокрасителя и реакцию обесцвечивания раствора калия перманганата в сернокислой среде. Подлинность норсульфазола-натрия подтверждали с помощью реакции образования азокрасителя и реакции комплексообразования с раствором меди (II) сульфата.
Для количественного определения новокаина и норсульфазола-натрия нами было отдано предпочтение физико-химическим методам, в частности, спектрофотометрии. Изучение спектров поглощения новокаина и норсульфазола-натрия в этаноле в области от 200 до 320 нм показало, что полосы поглощения растворов новокаина и норсульфазола-натрия налагаются по всей изученной области. Фон (полимерная основа) не обладала светопоглощением в указанной области. Для количественного определения ингредиентов в этом случае применяют различные расчетные варианты, в том числе модифицированный метод Фирордта. Метод заключается в параллельном измерении оптических плотностей анализируемого раствора и раствора многокомпонентного стандарта при выбранных аналитических длинах волн и последующего расчета содержания действующих веществ с помощью аналитических коэффициентов. Для получения наиболее воспроизводимых и правильных результатов важно правильно подобрать аналитические длины волн (АДВ). Критерием выбора АДВ по мнению ряда авторов являются коэффициенты Каца – Розкина, которые должны иметь максимально возможное значение. Информационные коэффициенты Каца – Розкина для каждого компонента рассчитывали при соответствующей длине волны согласно формуле:
![]() ,
,
где: rij - информационный коэффициент Каца – Розкина;
Сj – номинальные концентрации лекарственных веществ в лекарственном средстве;
Еij – удельные показатели поглощения ингредиентов лекарственного средства.
На основании расчетов информационных коэффициентов в качестве АДВ для количественного определения новокаина выбраны длины волн 225 и 290 нм, норсульфазола – натрия – 290 и 225 нм. Далее рассчитывали аналитические коэффициенты (а1 и а2) по формулам: a1 = r4/ r4× r1 – r2× r3 a2 = r2/ r4× r1 – r2× r3
Значения аналитических коэффициентов для новокаина составили 7,58 и 6,58, для норсульфазола-натрия 19,35 и 18,35. На основании проведенных исследований нами была предложена методика количественного определения новокаина и норсульфазола-натрия в СЛП: около 0,25 г пленок (точная навеска) помещают в мерную колбу вместимостью 50 мл, добавляют 30 мл спирта этилового, перемешивают, доводят этим же растворителем до метки, перемешивают и фильтруют, 1,0 мл полученного фильтрата доводят спиртом этиловым до метки в мерной колбе вместимостью 100 мл, перемешивают (раствор А). Одновременно готовят раствор многокомпонентного стандарта. Для этого, в мерную колбу вместимостью 100 мл вносят навески новокаина и норсульфазола натрия массой около 0,05 г, растворяют в 30 мл спирта этилового, доводят объем раствора до метки этим же растворителем, перемешивают. 1,0 мл полученного раствора доводят спиртом этиловым до метки в мерной колбе вместимостью 100 мл (раствор В). Измеряют оптическую плотность раствора А и раствора В на спектрофотометре при 225 нм и 290 нм в кюветах с толщиной слоя 1 см относительно растворителя. Содержание новокаина (Х1, г) и норсульфазола – натрия (Х2, г) рассчитывают соответственно по формулам:
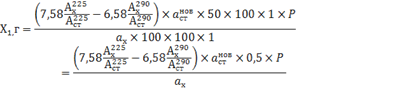
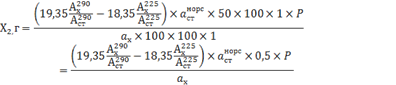
где: 7,58; 6,58; 19,35; 18,35 – аналитические коэффициенты;
![]() ,
, ![]() - оптические плотности анализируемого раствора (раствор А);
- оптические плотности анализируемого раствора (раствор А);
![]()
![]() - оптические плотности раствора многокомпонентного стандарта (раствор В);
- оптические плотности раствора многокомпонентного стандарта (раствор В);
![]() - масса навески СЛП, взятой на анализ, г;
- масса навески СЛП, взятой на анализ, г;
![]() ,
, ![]() - масса навесок новокаина и норсульфазола-натрия, взятой для приготовления раствора многокомпонентного стандарта, г;
- масса навесок новокаина и норсульфазола-натрия, взятой для приготовления раствора многокомпонентного стандарта, г;
![]() - общая масса СЛП, г.
- общая масса СЛП, г.
Результаты и их обсуждение. В результате проведенного эксперимента была определена матрица-носитель, обеспечивающая наибольший процент высвобождения действующих веществ. Полученные результаты представлены в таблицах 1 и 2. Оптимальной матрицей-носителем для новокаина является 3% раствор МЦ, а для норсульфазола-натрия - 6% раствор ПВС.
Таблица 1
Содержание новокаина в пробах диализата
|
Образец/Состав |
Экспозиция, мин / Концентрация новокаина, % |
|||
|
15 |
30 |
45 |
60 |
|
|
8% раствор желатина |
5,81 |
7,27 |
8,73 |
8,73 |
|
3% раствор МЦ |
8,73 |
9,46 |
10,18 |
10,91 |
|
4% раствор Na-КМЦ |
4,96 |
7,94 |
9,92 |
11,90 |
|
6% раствор ПВС |
6,00 |
9,60 |
13,19 |
14,39 |
|
Раствор (3% МЦ + 4% ПЭО 400) |
11,90 |
13,82 |
16,21 |
17,70 |
Таблица 2
Содержание норсульфазола-натрия в пробах диализата
|
Образец/Состав |
Экспозиция, мин / Концентрация норсульфазола-натрия, % |
|||
|
15 |
30 |
45 |
60 |
|
|
8% раствор желатина |
8,22 |
9,25 |
11,31 |
14,39 |
|
3% раствор МЦ |
13,36 |
15,42 |
17,47 |
20,55 |
|
4% раствор Na-КМЦ |
18,40 |
21,02 |
24,50 |
26,30 |
|
6% раствор ПВС |
21,02 |
23,80 |
28,00 |
30,80 |
|
Раствор (3% МЦ + 4% ПЭО 400) |
14,72 |
17,13 |
20,88 |
24,09 |
Далее был осуществлен выбор матрицы - носителя норсульфазола-натрия по антимикробной активности. Полученные результаты представлены в таблице 3.
Таблица 3
Зоны задержки роста микроорганизмов
|
Полимерная матрица |
Тест-культуры/ Зоны задержки роста, мм |
||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
8% раствор желатина |
16 |
16 |
12 |
15 |
11 |
14 |
- |
- |
16 |
|
3% раствор МЦ |
16 |
16 |
11 |
15 |
14 |
12 |
- |
- |
18 |
|
4% раствор Na-КМЦ |
21 |
20 |
22 |
30 |
23 |
26 |
- |
- |
26 |
|
6% раствор ПВС |
27 |
28 |
26 |
30 |
22 |
20 |
- |
- |
30 |
|
Раствор (3% МЦ + 4% ПЭО 400) |
18 |
18 |
18 |
26 |
26 |
24 |
18 |
16 |
28 |
Данные таблицы 3 свидетельствуют о том, что оптимально матрицей-носителем норсульфазола-натрия, обеспечивающей наибольшую антимикробную активность, является 6% раствор ПВС. Результаты, полученные при изучении степени и скорости высвобождения норсульфазола-натрия и определении антимикробной активности коррелируют между собой.
Изготовление двухслойных пленок осуществляли следующим способом: готовили раздельно каждый слой пленки, используя метод полива пленочной массы на подложку. Действующие вещества вводили растворным способом. Сушку пленок осуществляли при комнатной температуре в течение 3-х суток. В качестве мембраны (склеивающей 2 слоя и разделяющей) использовали 2% гель МЦ. Такая мембрана при высыхании прочно удерживает слои пленок и не препятствует высвобождению действующих веществ. Готовые пленки обладали эластичностью, имели размер 10×20 мм. Остаточная влажность – 9,8%, время растворения пленок 96±2 мин.
Важным показателем терапевтической эффективности пленок является дренажная способность, которая характеризует возможность очищения от экссудата пародонтальных карманов, очагов поражения при тяжелых формах гингивита, осложненного кариеса. Дренажную способность СЛП обеспечивает полимерная матрица, которая при соприкосновении с жидкостью (экссудатом) поглощает ее за счет полимерной структуры. Определение осмотической активности СЛП осуществляли методом диализа. Метод основан на измерении массы пленок во времени. Динамику изменения массы наблюдали в течение 3-х часов. Установлено, что полимерная матрица двухслойных СЛП способна в течение 2-х часов поглотить свыше 300 % жидкости. Определение дренажной способности пленок позволило их отнести к системам, обладающим высокой осмотической активностью.
Согласно разработанной методике количественного определения новокаина и норсульфазола-натрия был проведен анализ СЛП. Результаты определения представлены в таблицах 4 и 5.
Таблица 4
Результаты спектрофотометрического определения новокаина
|
а, г |
|
|
Х, г |
(Х‾ - Хi)2 |
Валидационные характеристики |
|
0,250 |
0,200 |
0,900 |
0,0237 |
0,00000016 |
X=0,0241 г
Прецизионность: RSD=2,54%
Правильность: R=100,2% RSD=2,00% |
|
0,251 |
0,205 |
0,906 |
0,0245 |
0,00000016 |
|
|
0,250 |
0,200 |
0,896 |
0,0244 |
0,00000009 |
|
|
0,249 |
0,197 |
0,892 |
0,0232 |
0,00000081 |
|
|
0,249 |
0,199 |
0,895 |
0,0237 |
0,00000016 |
|
|
0,251 |
0,202 |
0,904 |
0,0248 |
0,00000049 |
|
|
|
|||||
Таблица 5
Результаты спектрофотометрического определения норсульфазола-натрия
|
а, г |
|
|
Х, г |
(Х‾ - Хi)2 |
Валидационные характеристики |
|
0,250 |
0,200 |
0,900 |
0,0250 |
0,00000009 |
X=0,0247 г
Прецизионность: RSD=2,68%
Правильность: R=100,4% RSD=2,18% |
|
0,251 |
0,205 |
0,906 |
0,0249 |
0,00000004 |
|
|
0,250 |
0,200 |
0,896 |
0,0252 |
0,00000025 |
|
|
0,249 |
0,197 |
0,892 |
0,0234 |
0,00000169 |
|
|
0,249 |
0,199 |
0,895 |
0,0250 |
0,00000009 |
|
|
0,251 |
0,202 |
0,904 |
0,0249 |
0,00000004 |
|
|
|
|||||
Данные таблиц 4 и 5 свидетельствуют о том, что разработанная методика удовлетворяет аналитическим задачам, следовательно, ее можно использовать для количественного определения новокаина и норсульфазола-натрия в СЛП.
Выводы. Изучены оптимальные полимерные носители действующих веществ в двухслойных СЛП; предложены состав, технология и методы анализа двухслойных СЛП. Действующие вещества, входящие в состав двухслойных СЛП – новокаин, норсульфазол-натрий и сок каланхоэ, обеспечивают противовоспалительное, местноанестезирующее, антимикробное действие; обладают выраженной дренажной способностью и способствуют регенерации тканей.
Рецензенты:
Лазарян Д.С., д.ф.н., профессор, заведующий кафедрой фармацевтической и токсикологической химии ПМФИ - филиала ГБОУ ВПО ВолгГМУ МЗ РФ, г. Пятигорск.
Компанцева Е.В., д.ф.н., профессор кафедры фармацевтической и токсикологической химии ПМФИ - филиала ГБОУ ВПО ВолгГМУ МЗ РФ, г. Пятигорск.



