Введение
Молекула пепсина состоит из полипептидной цепи, содержащей 327 аминокислотных остатков, и одного остатка фосфорной кислоты, образующего фосфоэфирную связь с гидроксильной группой остатка серина в положении 68 (отщепление фосфатной группы не сказывается на ферментативных свойствах пепсина). Молекулярный вес пепсиногена равен 42 000, пепсина — 35 000. Оптимум рН для пепсина составляет 1,5—2. Большая часть фермента поступает в желудок и играет там активную роль в процессе пищеварения, но некоторое количество пепсиногена переходит в кровяное русло и выделяется почками.
В фундальных железах желудка ежедневно образуется 1 г пепсиногена, который в полости желудка под действием соляной кислоты активируется, превращаясь в пепсин. Выделен ингибитор пепсина — пептид с молекулярным весом около 3000, который образуется из пепсиногена при его превращении в пепсин. Во время активации образуется промежуточное соединение пепсина с полипептидным ингибитором, которое легко диссоциирует при низких значениях рН, а ингибитор переваривается пепсином. При рН>5 диссоциация незначительна и происходит ингибирование пепсина. Реакция ингибирования и активирования часто идет одновременно. В зависимости от условий проведения реакции будет преобладать то или иное направление. Пепсин, соляную кислоту относят к агрессивным факторам желудочного сока, но пепсин, присутствуя постоянно в желудочном соке, не повреждает собственную слизистую. Пепсин вырабатывается главными клетками желёз дна и тела желудка. У мужчин дебит пепсина составляет от 20 до 35 мг в час (базальная секреция) до 60-80 мг в час (секреция, стимулированная пентагастрином, максимальная). У женщин — на 25-30 % меньше. Главными клетками пепсин секретируется, резервируется и выводится в неактивной форме в виде профермента пепсиногена. Превращение пепсиногена в пепсин происходит в результате отщепления с N-концевого участка пепсиногена состоящего из нескольких пептидов, один из которых играет роль ингибитора. Процесс активации идёт в несколько стадий и катализируется соляной кислотой желудочного сока и самим пепсином (автокатализ). Пепсин обеспечивает дезагрегацию белков, предшествующую их гидролизу, что облегчает дальнейшее расщепление в двенадцатиперстной кишке. Как катализатор он обладает протеазным и пептидазным действием. Протеолитическая активность пепсина наблюдается при рН < 6, достигая максимума при pH = 1,5 — 2,0. При этом один грамм пепсина за два часа может расщеплять ~50 кг яичного альбумина, створаживать ~100000 л молока, растворять ~2000 л желатины. Имея такую протеолитическую активность к разным субстратам, в условиях нормального состояния остается малоактивным к собственной слизистой оболочке.
Кроме пепсина, в состав желудочного сока входят еще несколько сопутствующих протеолитических ферментов (гастриксин, катепсин Б). Дефосфорилирование пепсина не уничтожает его ферментативной активности. Пепсин наиболее устойчив при рН=5—5,5, в более кислой среде происходит самопереваривание его и ингибитора в щелочной инактивация.
Всего известно от 3 до 11 изоформ пепсина [1, 2], которые различаются молекулярным весом, электрофоретической подвижностью, оптимумами рН протеолитической активности, при разном значении рН с неодинаковой скоростью гидролизуют разные белки. Полноценный состав желудочного сока находится в зависимости от механизмов регуляции секреции клеток слизистой оболочки желудка (СОЖ) [3, 4]. Нарушение системы регуляции может произойти в случае стресса.
Целью исследования было выявление агрессивных и защитных свойств СОЖ в период стресса.
Материал и методы
Экспериментальное исследование проводили на конвенциональных белых крысах (питомник «Пущино») массой 180 – 220 г. Животных содержали согласно соответствующем нормативам ГОСТа, при температуре 18-200 С. С учетом общепринятых в настоящее время в мире стандартов гуманного использования животных при проведении экспериментального исследования. А также принятые Россией в 2003 году международные правила GLP (Правила надлежащей лабораторной практики; приказ МЗ РФ от 19 июня 2003 г. № 267). Для обезболивания использовали эфирный наркоз. Эфир давали из расчета 3-5 мл на 1 кг массы тела через маску в смеси с атмосферным воздухом.
Всего было использовано 50 белых крыс обоего пола. Перед оперативным вмешательством крыс не кормили 18 часов, оставляя свободный доступ к воде [5, 6].
Для проведения исследования животные были распределены на группы в зависимости от динамики развития и заживления операционной раны. Основная группа – 5 животных на третьи сутки после оперативного вмешательства и 5 животных без оперативного вмешательства. Отделяя серозную оболочку, иссекали слизистую, которую не промокали фильтровальной бумагой - ткань + отек (Т+О). Опускали выделенный кусочек ткани в пробирку с 3 мл физиологического раствора. Помещали пробирку в холодильник, через 30 минут определяли рН раствора. Затем при данном значении рН определяли уровень протеолитической активности. В качестве субстрата использовали бычий гемоглобин. У интактных животных иссекали ткань в том же месте, что и у оперированных животных - контроль (К).
Результаты и обсуждение
Третьи сутки послеоперационного периода - пик воспалительной реакции на оперативное вмешательство.
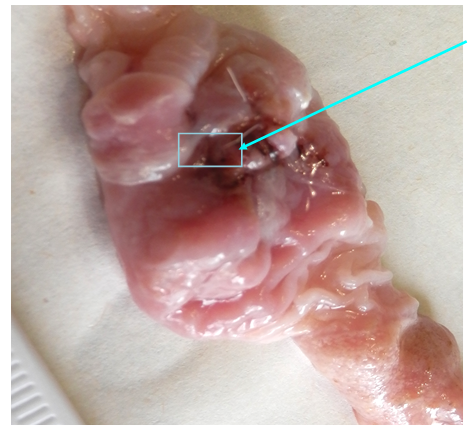
Рис. 1. Слизистая оболочка желудка. Операционный шов 3-и сутки после операции. Выделено место взятия биоптата (50 мг ткани).
Как видно на макрофотографии слизистая оболочка (СО) желудка резко отечна, гиперемирована (рис. 1). Усилен сосудистый рисунок, имеются фиброзные наложения как на слизистой желудка, так и на двенадцатиперстной кишке (ДПК). СО рыхлая, складчатость нарушена, рядом с операционным швом кровоизлияния и эрозии. В ДПК – обильная воспалительная инфильтрация слизистой оболочки.
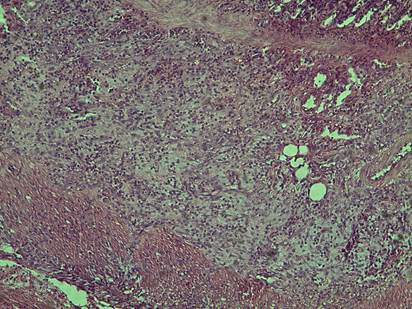
Рис. 2. Мышечная и слизистая оболочка желудка. Операционный шов 3-и сутки после операции.
Микроскопически в мышечном слое стенки желудка животного отмечается выраженная крупноочаговая полиморфноклеточная инфильтрация (рис. 2).
Учитывая макро- и микрокартину послеоперационной раны желудка на третьи сутки после вмешательства, провели определение свободной протеолитической активности в отечной жидкости в месте воспаления. У опытных животных после инкубации в холодильнике рН раствора равнялся 4,5-5,0. У интактных животных 6,5-7,0. рН до 4,5-5,0 доводили буферным раствором. Затем в пробах определяли уровень протеолитической активности. В качестве сравнения уровень протеолитической активности определяли в растворе, в который помещали биоптат после тщательного промокания фильтровальной бумагой, стараясь по возможности удалить отечную жидкость - ткань- отек (Т-О). Как видно на рисунке, наиболее высокий уровень протеолитической активности в случае инкубации ткани с отеком (рис.3). Мы предполагаем, что в инкубационную жидкость попадает активированный внутритканевой пепсиноген. В контроле он практически отсутствует, достоверно меньше активированного пепсиногена в случае предварительного удаления отечной жидкости.
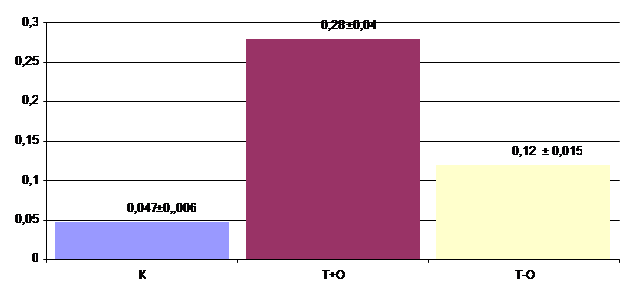
Рис. 3. Уровень свободной внутритканевой протеолитической активности при рН – 4,5- 5,0.
Вывод
Таким образом, в слизистой оболочке желудка помимо повреждающих факторов, которые присущи любому процессу воспаления присутствует значительный агрессивный фактор – это внутритканевая активация синтезируемый главными клетками суперактивный протеолитический фермент пепсин [7].
Рецензенты:
Белостоцкий Н.И., д.м.н., старший научный сотрудник лаборатории доклинических исследований ГБУЗ «Московский клинический научно-практический центр» ДЗМ, г.Москва.
Варванина Г.Г., д.м.н., старший научный сотрудник лаборатории научно-диагностических исследований ГБУЗ «Московский клинический научно-практический центр» ДЗМ, г.Москва.



