Введение
Одним из ведущих патофизиологических механизмов защиты в ответ на внедрение инфицирующего агента, введение антигена или физическое повреждение тканей является воспаление. Механизм течения воспалительного процесса сложен и многогранен. Несмотря на большой фактический материал, собранный исследователями, на данном этапе развития науки актуальным становится поиск патогенетических связей, раскрытие регуляторных механизмов при различных воспалительных заболеваниях. Важным механизмом поддержания корректного числа клеток в многоклеточном организме является апоптоз или программированная клеточная смерть. В иммунной системе он является одним из основных регуляторов численности популяций клеток. Именно этот процесс ограничивает экспансию активированных клонов, препятствуя развитию воспаления и аутоиммунных реакций. «Активационный» апоптоз развивается в результате дисбаланса активационных сигналов и / или вследствие экспрессии и последующего связывания специализированных рецепторов индукции апоптоза. Процесс запрограммированной гибели клетки осуществляется и контролируется иммунными механизмами [1, 2, 9]. Путем апоптоза регулируется ответ иммунокомпетентных клеток на антигенные стимулы, определяется характер, динамика и длительность иммунного ответа, формирование иммунологической толерантности.
В ХХ веке был открыт на цитоплазматической мембране клеток первый специализированный рецептор из семейства TNF-рецепторов для индукции апоптоза – CD95 (Fas/Apo-l). Описан соответствующий индукторный фактор Fas-лиганд. Fas-лиганд экспрессируется на поверхности лимфоцитов. Экспрессия Fas-рецептора на клеточной мембране означает готовность клетки к апоптозу, однако для запуска процесса необходимо действие индукторов. Известна группа физиологических активаторов и ингибиторов апоптоза [3, 8]. В качестве индуцирующих апоптоз факторов выступают провоспалительные цитокины (ФНО-α, γ-интерферон). Этот показатель был предложен в качестве субклинического предвестника активизации иммунопатологического процесса.
В иммунной системе CD95 и CD95L вовлечены в опосредованную T-лимфоцитами цитотоксичность. На периферии зрелые Т-клетки, распознавая аутоантигены, элиминируются с участием Fas-рецепторов. Для обеспечения удаления активированных лимфоцитов в завершающей фазе иммунного ответа должен быть запущен процесс устранения лимфоцитов [1, 4]. В основном CD95L экспрессируется активированными CD4+и CD8+ Т-клетками, в то время как покоящиеся Т-лимфоциты не экспрессируют Fas-лиганд. [5]. T-хелперы 1 типа способны лизировать клетки-мишени более активно, чем T-хелперы 2 типа путем Fas-опосредованного механизма [9]. При взаимодействии CD95+-лимфоцитов с лигандом (мембранным или растворимым) инициируется возможность запуска процесса апоптоза, который может быть подавлен антиапоптотическим действием продуктов генов, блокирующих апоптоз. Поэтому снижение процентного содержания лимфоцитов, чувствительных к индукции апоптоза, может быть причиной нарушения процесса элиминации активированных форм лимфоцитов. Поскольку апоптоз играет важную роль в элиминации аутореактивных клеток, контролирует длительность, интенсивность иммунного ответа, степень повреждения тканей и является механизмом, поддерживающим баланс лимфоидных клеток в организме [5, 4], то изучение особенностей этого процесса при патологии носит важный прогностический характер.
Актуальность данного исследования объясняется все большим распространением в последнее время воспалительных заболеваний с вялотекущими процессами и возникающей в связи с этим необходимостью углубленного изучения патогенетических механизмов воспаления с позиций типового патологического процесса.
Цель исследования – изучить проапоптические факторы (экспрессию CD95 на лимфоцитах крови, цитокиновые факторы регуляции апоптоза) у больных острыми и хроническими абдоминальными заболеваниями.
Материал и методы исследования. В исследовании принимали участие 30 здоровых доноров крови и 176 больных с острой и хронической абдоминальной патологией. Кровь на обследование забирали при поступлении пациента в больницу с явлениями «острого живота». Среди обследованных больных у 40 пациентов имелась острая абдоминальная патология в виде острого флегмонозного аппендицита (ОФА); у 17 больных – острый гангренозный аппендицит (ОГА); у 27 больных – острый неспецифический мезаденит (ОМ); у 40 больных – абдоминальный туберкулез (АТ). Диагнозы выставляли на основании гистологического заключения после апендектомии. Кроме того, отдельно изучали влияние иммунопровокационной пробы Коха на иммунный статус больных АТ (40 обследованных) (группа АТК). Пробу Коха проводили с 20 туберкулиновыми единицами очищенного туберкулина с подкожным его введением. При активном туберкулезе через 72 часа после подкожного введения туберкулина возникала общая, местная и очаговая реакция. Для оценки пробы Коха дополнительно изучали изменения в иммунном статусе.
Из показателей иммунного статуса определяли абсолютное количество лимфоцитов (ЛЦ) в крови и их популяционный состав непрямым иммунофлюорисцентным методом с использованием моноклональных антител к дифференциировочным антигенам («Сорбент», Москва, РФ). Определяли количество Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-цитотоксических лимфоцитов (CD8+), NK-клеток (CD56+), маркер негативной активации CD95+ (Fas рецептор). Концентрацию интерелейкина 2 (IL-2), фактора некроза опухоли α (TNF-α) в сыворотке крови определяли с помощью иммуноферментных тест-систем (“Diaclone” Франция). Математическую обработку полученных результатов проводили методами описательной и непараметрической статистики с использованием программы «STATISTICA 6.0».
Результаты исследования и их обсуждение
С целью изучения особенностей клеточного звена иммунитета при острых и хронических абдоминальных заболеваниях изучали популяционную структуру лимфоцитов периферической крови. Результаты исследования представлены в таблице 1.
Таблица 1
Популяционная структура лимфоцитов периферической крови больных острыми и хроническими абдоминальными заболеваниями, M±m.
|
|
Контроль, n=30 |
ОМ, n=27 |
ОФА, n=41 |
ОГА, n=17 |
АТ, n=60 |
АТК, n=40 |
|
ЛЦ, Г/л |
2,0±0,08 |
2,17±0,16 |
1,79±0,02 |
2,06±0,03 |
2,05±0,03 |
2,44±0,01* |
|
СD3+, Г/л |
1,07±0,08 |
1,1±0,12 |
0,91±0,08* |
1,05±0,16 |
1,06±0,09 |
1,30±0,02*# |
|
СD4+, Г/л |
0,93±0,05 |
0,65±0,08* |
0,50±0,04* |
0,62±0,09*$ |
0,67±0,05* |
0,80±0,06*# |
|
СD8+, Г/л |
0,33±0,04 |
0,45±0,06* |
0,39±0,03 |
0,43±0,06* |
0,37±0,03 |
0,50±0,04*# |
|
СD56+, Г/л |
0,15±0,01 |
0,51±0,06* |
0,41±0,04* |
0,46±0,07* |
0,44±0,04* |
0,51±0,04*# |
Примечание: * – достоверность отличия показателя по сравнению с контролем; # – достоверность отличия показателя по сравнению с группой АТ; $ – достоверность отличия показателя по сравнению с группой с ОФА, (р<0,05).
Установлено, что уровень лимфоцитов во всех обследованных группах существенно не отличался от показателя в контрольной группе. Однако внутри популяции лимфоцитов наблюдается определенное перераспределение. Как при остром воспалении, так и при хроническом, достоверно снижен уровень Т-хелперов. В группе с ОМ наблюдали достоверное (р < 0,05) снижение количества Т-хелперов на 30 %, в группе с ОФА – на 46 %, в группе ОГА – на 33 %, в группе АТ – на 28 %, при обострении абдоминального туберкулеза (группа АТК) – на 14 % по сравнению с контрольной группой. Поскольку Т-хелперы определяют интенсивность и направленность иммунологических реакций их уменьшение в периферической крови возможно связано с рециркуляцией лимфоцитов и участием этих клеток в иммунологических реакциях в зонах воспаления. Обострение туберкулезного процесса вызвало повышение лимфоцитов в периферической крови на 19 % и всех субпопуляций по сравнению с группой с АТ.
При острых неспецифических абдоминальных заболеваниях (мезаденит, острый гангренозный аппендицит) наблюдалось увеличение пула Т-цитотоксических лимфоцитов (СD8+) в то время как при АТ количество СD8+ лимфоцитов не отличалось от контрольного значения. Однако при обострении хронического воспаления посредством проведения пробы Коха уровень Т-цитотоксических лимфоцитов повысился на 35 % по сравнению с уровнем при хроническом процессе. Такая картина еще раз подтверждает тот факт, что при бактериальных процессах Т-цитотоксические лимфоциты являются основными эффекторными клетками [6].
Наряду с выраженным субпопопуляционным дисбалансом среди Т-лимфоцитов в периферической крови наибольшие отклонения обнаружены для СD56+- лимфоцитов (NK-клеток). Повышение количества NK-клеток носило выраженный характер с высокой степенью достоверности, как при острых воспалительных заболеваниях, так и при хронических специфических процессах. При остром мезадените и обострении абдоминального туберкулеза (АТК) уровень натуральных киллеров (СD56+) был в 3 раза выше контрольных показателей.
Такие изменения популяционного состава лимфоцитов крови закономерно дополняют картину угнетения Т-клеточного звена с повышением продукции цитотоксических клеток-эффекторов при воспалительных процессах. На основании полученных результатов исследований можем сделать заключение об активации клеточно-опосредованных механизмов иммунитета, особенно килерного звена, на фоне умеренного Т-клеточного иммунодефицита.
Поскольку одним из иммунорегуляторных механизмов является апоптоз, то следующим этапом исследований была оценка экспрессии CD95 на лимфоцитах крови, как мембранного маркера готовности к апоптозу. Изучение процессов апоптоза выступает неотъемлемой частью изучения иммунопатологических процессов на данный час [7]. В связи с этим была произведена оценка относительного количества лимфоцитов в периферической крови, экспрессирующих Fas-рецептор. Результаты представлены на рис. 1.
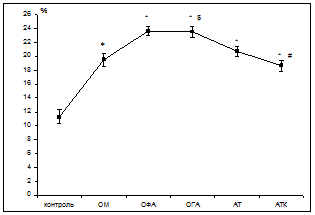
Рис. 1. Экспрессия CD95 на лимфоцитах периферической крови при острых и хронических абдоминальных заболеваниях, M±m
Примечание: * – достоверность отличия показателя по сравнению с контролем; # – достоверность отличия показателя по сравнению с группой АТ; $ – достоверность отличия показателя по сравнению с группой с ОМ (р<0,05).
В результате исследований выявлено достоверное (р<0,05) повышение во всех группах обследованных количества лимфоцитов крови, экспрессирующих CD95. Так при ОМ уровень CD95+-лимфоцитов составил 19,53 ± 0,98 %, что в 1,7 раза выше контрольного значения (11,3 ± 0,97 %). При ОФА и ОГА уровень лимфоцитов, экспрессирующих Fas-рецептор, был в 2 раза выше; при абдоминальном туберкулезе – в 1,8 раза выше контрольного значения; при АТ после пробы Коха – в 1,7 раза выше. Известно, что экспрессия клетками CD95 отражает лишь готовность клетки к рецепции апоптогенного сигнала и повышается она при активации клетки. Снижение активности процессов апоптоза при выраженной активации лимфоцитов приводит к развитию аутоиммунной и онкопатологии [1, 2, 7]. Наши исследования показали, что при активном остром воспалительном процессе наряду с активацией иммунокомпетентных клеток уровень клеток, экспрессирующих Fas-рецептор, повышен независимо от нозологии.
Следующим этапом было определение участия цитокинов в регуляции апоптоза. Известно, что TNF-α является мощным индуктором апоптоза, а IL2 – относится к физиологическим ингибиторам апоптоза. Интерлейкин 2 продуцируют активированные Т-хелперы 1 типа, которые также продуцируют и некоторое количество TNF-α [5]. Результаты исследований представлены на рис. 2.
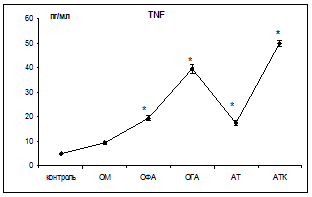
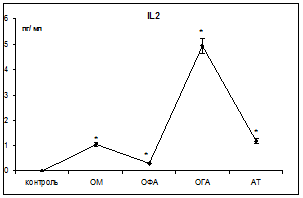
Рис. 2. Концентрация TNFα и IL2 в сыворотке крови при воспалительных заболеваниях органов брюшной полости
Примечание: * – достоверность отличия показателя по сравнению с контролем (р<0,05).
При ОГА более выражено достоверное возрастание концентрации TNF-α (в 7,9 раз) по сравнению с контрольной группой. При ОФА концентрация TNF-α достоверно (р<0,05) в 3,9 раз превышает уровень контроля. Также сравнительный анализ результатов показал, что TNF-α определяется в высоких концентрациях при деструктивных формах воспаления: при ОГА концентрация TNF-α в 2 раза выше (р<0,05) по сравнению с ОФА. При АТ уровень TNF-α в 3,5 раза выше контрольного значения и после проведения пробы Коха возрастает еще в 2,8 раза. Концентрация IL2 в сыворотке крови практически здоровых людей ничтожно мала 0,01±0,001 пг/мл. При воспалении его уровень возрастает в десятки раз и при ОГА соответствовал 4,93±0,3 пг/мл, при АТ – 1,16±0,1 пг/мл.
Уровни исследуемых цитокинов не превышают 50 пг/мл для TNF-α и 5 пг/мл для IL2, что свидетельствует об активации иммунорегуляторных процессов. Таким образом, наши исследования подтверждают тот факт, что при воспалении (хроническом и остром) наблюдается повышенный уровень экспрессии CD95 (готовность к апоптозу), а различия выявлены для IL2 и TNF-α, которые являются регуляторами процесса апоптоза. Изучения особенностей цитокиновой регуляции апоптоза лимфоцитов крови дают возможность прогнозировать развитие воспалительного процесса при заболеваниях, выявить дисбаланс иммунорегуляторных механизмов, оптимизировать диагностическую и лечебную тактику.
Выводы. В результате проведенных исследований установлено что, как при хроническом, так и при остром воспалении наблюдается повышенный уровень экспрессии CD95 на лимфоцитах периферической крови (готовность к апоптозу). Различия выявлены для концентрации IL2 и TNF-α, в сыворотке крови, которые на системном уровне являются регуляторами процесса апоптоза. Изучения особенностей цитокиновой регуляции апоптоза лимфоцитов крови дают возможность расширить знания о развитии воспалительного процесса с позиций типового патофизиологического процесса.
Рецензенты:
Лаповец Л.Е., д.м.н., профессор, заведующая кафедрой клинической лабораторной диагностики Львовского национального медицинского университета имени Данила Галицкого, г. Львов.
Скибчик В.А., д.м.н., профессор кафедры семейной медицины Львовского национального медицинского университета имени Данила Галицкого, г. Львов.



