Несмотря на усилия мирового сообщества, широкая распространенность сердечно-сосудистых заболеваний (ССЗ) и высокая смертность по-прежнему сохраняются. Почти 50% недожития мужчин обусловлено ишемической болезнью сердца (ИБС) [1]. Среди факторов риска, влияющих на смертность от ССЗ в целом и острого коронарного синдрома (ОКС) в частности, немалую роль играют такие факторы, как ожирение, сахарный диабет, факторы системного воспаления [2, 3]. В настоящее время предлагаются современные программы реабилитации больных с ОКС на основе комплексного учета не только состояния сердечно-сосудистой системы, но и факторов риска, коморбидной патологии [4, 5].
Оперативное лечение больных с ОКС является динамично развивающимся направлением современной кардиологии. При этом активное обсуждение путей снижения летальности больных с ОКС основано не только на выборе тактики реваскуляризации, но и на активном воздействии на факториальный и коморбидный фон [6, 7].
Адипокины, вырабатываемые адипоцитами преимущественно из периваскулярных жировых зон и иммунокомпетентными клетками, оказывают влияние на инсулинорезистентность, а также на процессы ремоделирования сосудистой стенки и миокарда. К адипокинам, стимулирующим процессы ремоделирования и повышающим риск развития сердечно-сосудистых осложнений, относятся резистин, висфатин, грелин, хемерин, лептин и FGF-21, а к адипокинам, противостоящим данным процессам, – адипонектин, оментин, апелин [8].
Резистин относится к адипокинам и характеризуется наличием 10–11 остатков цистеина. Резистин человека играет важную регуляторную роль в формировании воспалительного ответа, и макрофаги, мононуклеарные клетки периферической крови и гладкомышечные и эндотелиальные клетки сосудов являются основными мишенями резистина. В последние годы появляется все больше данных, указывающих на то, что резистин связан с заболеваниями коронарных и периферических артерий, ишемическим инсультом и застойной сердечной недостаточностью. Повышенный уровень резистина является фактором риска развития коронарного атеросклероза, а также предиктором рестеноза после стентирования коронарной артерии и неблагоприятных сердечно-сосудистых событий у пациентов с ИБС [9, 10].
Фибриноген – белок системного воспаления, также влияющий на сердечно-сосудистый риск. Гиперфибриногенемия является фактором риска тяжелого течения острого инфаркта миокарда (ОИМ), а также смерти при ОКС. В случае гиперфибриногенемии при ОКС возрастает риск кардиальных осложнений, в том числе после чрескожного коронарного вмешательства (ЧКВ). Повышается риск коронарного рестеноза, а также сосудистых поражений других локализаций, в частности периферической сосудистой болезни, каротидного атеросклероза [11, 12].
Исходя из вышесказанного целью исследования являлось изучение совместного действия резистина и фибриногена на состояние сердечно-сосудистой системы в отдаленном периоде у больных после ЧКВ и процедуры стентирования.
Материал и методы исследования
Исследование выполнено на базе кафедры внутренних болезней № 4 ФГБОУ ВО СОГМА Минздрава России, набор пациентов осуществлялся в кардиологическом отделении № 1 (неотложном) ГБУЗ РКБ МЗ РСО-А.
Критерии включения: ОКС с последующим выполнением ЧКВ с восстановлением коронарного кровотока инфаркт-зависимой/клинико-зависимой артерии путем стентирования.
Критерии невключения: многососудистые поражения коронарного русла, когда не проводилось полной реваскуляризации миокарда, а также болезни печени с синдромом мальабсорбции, первичные заболевания почек и снижение фильтрационной функции, опухолевые заболевания, возраст менее 18 лет, а также ранее осуществленная процедура стентирования или шунтирования.
В данное исследование были включены 120 больных с ОКС. Возраст составил 57,7±8,9 года и колебался от 33 до 77 лет. Среди обследованных больных были 101 мужчина и 19 женщин, что составило 84,2% и 15,8% соответственно.
Диагноз «нестабильная стенокардия» (НС) был установлен 68 больным (56,7%), ОИМ установлен 52 больным (43,3%), при этом ОИМ с зубцом Q – 35,8%, ОИМ без зубца Q – 7,5%%, ОИМ с подъемом сегмента ST – 31,7%, ОИМ без подъема сегмента ST – 11,7%.
Обследование выполнялось по единому протоколу и включало два этапа. На первом этапе выявляли факторы риска на основе клинических, лабораторных (анализатор Sysmex XT 2000i, Japan; ALIFAX TEST-1, Italy), инструментальных методов (ЭКГ, ЭхоКГ, коронароангиография), биоимпедансоспектрометрии (с помощью анализатора водных секторов «Диамант АИСТ-мини») в период до реваскуляризации миокарда. Проводился учет уровней резистина (методом количественного иммуноферментного анализа) на основе системы для мультиплексного анализа Luminex MAGPIX (USA), фибриногена (клоттинговым методом по Клауссу с применением автоматического коагулометра).
Второй этап заключался в повторном опросе больных в позднем периоде после реваскуляризации миокарда (8,2+0,3 месяца), а также регистрации конечных точек. В качестве конечных точек были выбраны такие сердечно-сосудистые осложнения, как аритмии (появление хронической наджелудочковой или желудочковой тахиаритмии, фибрилляции/трепетания предсердий, блокады атриовентрикулярного соединения 2–3-й степени, би- и трифасцикулярной блокады ножек пучка Гиса, желудочковой тахикардии, фибрилляции желудочков, асистолии), повторный ОКС, случаи госпитализации по причине обострения хронической сердечной недостаточности (ХСН), комбинированные точки: аритмия и/или повторный ОКС, все осложнения (аритмия и/или повторный ОКС и/или госпитализация по причине ХСН).
Статистическая обработка полученной информации проводилась с помощью компьютерных программ Micr.Office Excel 2010 и Statistica 10.0. Нормальность распределения определяли с помощью метода Колмогорова–Смирнова с поправкой Лиллифорта. При нормальном распределении признака в когорте определяли M±SD, где M – среднее арифметическое, SD – стандартное отклонение, при ненормальном определяли Me [Q1–Q3] (Me – медиана, Q1 и Q3 – 1-й и 3-й квартили). В случае нормального распределения применяли критерий Стьюдента или критерии Манна–Уитни и χ2 с определением F при ненормальном. Логит-регрессионный анализ с оценкой относительных рисков возникновения события (OR) и определением χ2 использовали для расчета вероятности развития события. При этом уровни резистина и фибриногена были независимыми переменными, а сердечно-сосудистые осложнения были зависимыми.
Результаты исследования и их обсуждение
Для определения совместного действия резистина и фибриногена на состояние сердечно-сосудистой системы в отдаленном периоде у больных после ЧКВ и процедуры стентирования исследуемая группа пациентов была разделена на подгруппы: пациенты с комбинацией уровня резистина более 8,5 нг/мл и фибриногена менее 5,0 г/л, пациенты с комбинацией уровня резистина менее 8,5 нг/мл и фибриногена более 5,0 г/л, пациенты с комбинацией уровня резистина более 8,5 нг/мл и фибриногена более 5,0 г/л и пациенты с комбинацией уровня резистина менее 8,5 нг/мл и фибриногена менее 5,0 г/л.
Для подтверждения синергического влияния диады резистин-фибриноген на риск развития сердечно-сосудистых осложнений нами проведен логит-регрессионный анализ влияния комбинации упомянутых факторов на риск развития конечных точек. С этой целью была выбрана двухфакторная модель анализа (табл. 1).
Таблица 1
Результаты логит-регрессионного анализа влияния пар факторов на риск развития сердечно-сосудистых осложнений
|
Риск развития события |
Const.B0 |
OR (range) |
OR (range) |
χ2 |
р |
|
|
|
Резистин нг/мл |
Фибриноген г/л |
|
|
|
Аритмия |
–4,8 |
190,3 |
0,07 |
8,4 |
0,015 |
|
Повторный ОКС |
–2,9 |
3,2 |
4,6 |
4,9 |
0,085 |
|
Госпитализация по причине ХСН |
–3,8 |
2,3 |
17,9 |
7,5 |
0,023 |
|
Аритмия и/или повторный ОКС |
–3,0 |
8,5 |
3,0 |
9,7 |
0,008 |
|
Все осложнения |
–3,0 |
6,5 |
32,7 |
26,4 |
<0,00001 |
В случае изучения риска развития сердечно-сосудистых осложнений в паре факторов резистин-фибриноген было показано несколько статистически значимых влияний. В частности, реализация негативных эффектов резистина на риск развития аритмии происходила у больных с низкими значениями фибриногена (рис. 1). Данный факт, вероятно, объясняется разными механизмами формирования рисковой нагрузки у этих двух факторов в отношении именно данной конечной точки.
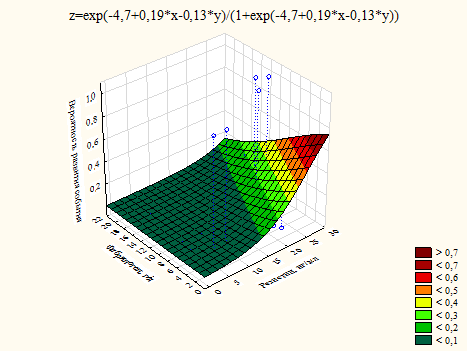
Рис. 1. График влияния уровня резистина и фибриногена на риск развития аритмии
При анализе влияния на другие конечные точки данные факторы риска также демонстрировали разное влияние. Риск госпитализации по причине обострения ХСН нарастал по мере повышения уровня фибриногена, но при условии снижения уровня резистина, т.е., как и в случае с риском аритмий, механизмы формирования рисковой нагрузки в паре этих факторов были разными, что формировало разнонаправленность их влияния, при том что в отдельности каждый их них негативно влиял на риск сердечно-сосудистых осложнений (рис. 2).
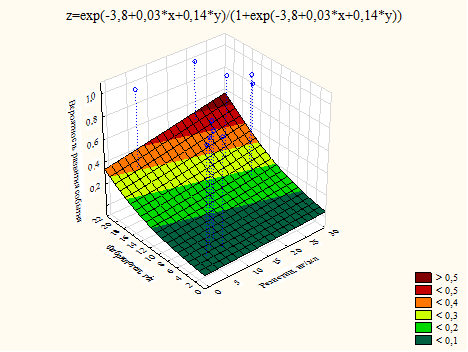
Рис. 2. График влияния уровня резистина и фибриногена на риск госпитализации по причине ХСН
В случае риска развития аритмии и/или повторного ОКС и риска всех осложнений эти факторы демонстрировали содружественное влияние на риск (рис. 3, 4).
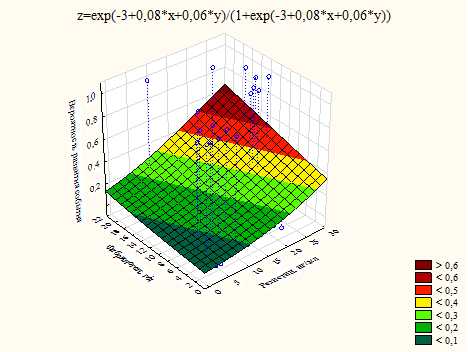
Рис. 3. График влияния уровня резистина и фибриногена на риск развития аритмии и/или повторного ОКС
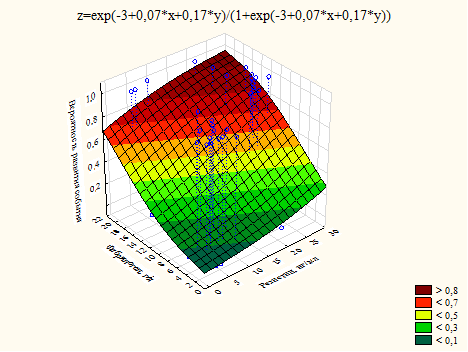
Рис. 4. График влияния уровня резистина и фибриногена на риск развития всех осложнений
При оценке частоты возникновения сердечно-сосудистых осложнений в течение 8 месяцев у больных ОКС с ЧКВ со стентированием набольшее количество осложнений встречалось в подгруппе пациентов с комбинацией уровня резистина более 8,5 нг/мл и фибриногена более 5,0 г/л, тогда как в подгруппе пациентов с комбинацией уровня резистина более 8,5 нг/мл и фибриногена менее 5,0 г/л было меньше всего осложнений (р<0,05) (табл. 2). Полученные нами данные согласуются с ранее проведенным логит-регрессионным анализом и подтверждают влияние диады резистин-фибриноген на риск развития сердечно-сосудистых осложнений в отдаленном периоде у больных после ЧКВ и процедуры стентирования.
Таблица 2
Частота возникновения сердечно-сосудистых осложнений у обследованных больных
|
Осложнения |
Пациенты с уровнем резистина более 8,5 нг/мл и фибриногена менее 5,0 г/л (I подгруппа) |
Пациенты с уровнем резистина менее 8,5 нг/мл и фибриногена более 5,0 г/л (II подгруппа) |
Пациенты с уровнем резистина более 8,5 нг/мл и фибриногена более 5,0 г/л (III подгруппа) |
Пациенты с уровнем резистина менее 8,5 нг/мл и фибриногена менее 5,0 г/л IV подгруппа) |
||||
|
n |
% |
n |
% |
n |
% |
n |
% |
|
|
Аритмия |
1 |
0,83 |
– |
– |
3 |
2,5 |
1 |
0,83 |
|
Повторный ОКС |
1* |
0,83 |
2 |
1,66 |
7 |
5,83 |
4 |
33,33 |
|
Госпитализация по причине ХСН |
– |
– |
2 |
1,66 |
5 |
4.16 |
3 |
2,5 |
|
Аритмия и/или повторный ОКС |
2* |
1,66 |
2** |
1,66 |
9 |
7,5 |
4 |
33,33 |
|
Все осложнения |
2* |
1,66 |
4** |
33,33 |
15 |
12,5 |
7# |
5,83 |
Примечание: * – различия достоверны между I и III подгруппами (р<0,05); ** – различия достоверны между II и III подгруппами (р<0,05); # – различия достоверны между III и IV подгруппами (р<0,05).
Заключение
В ходе проспективного исследования группы больных, перенесших ОКС со стентированием, было показано, что низкие значения фибриногена в крови (уровень фибриногена менее 5,0 г/л) и высокий уровень резистина (уровень резистина выше 8,5 нг/мл), определенные до процедуры КАГ, являются фактором риска развития аритмии. Высокий уровень фибриногена, ассоциированный с низким уровнем резистина, является фактором риска госпитализации по причине обострения ХСН. Повышенный риск развития конечных точек: аритмии и/или повторного ОКС, а также всех осложнений отмечался при гиперрезистинемии и гиперфибринемии.
Библиографическая ссылка
Авсарагова А.З., Астахова З.Т., Ремизов О.В., Беленчеков А.А. СИНЕРГИЧЕСКОЕ ВЛИЯНИЕ АДИПОКИНОВ И БЕЛКОВ ОСТРОЙ ФАЗЫ НА РИСК СЕРДЕЧНО-СОСУДИСТЫХ ОСЛОЖНЕНИЙ НА ПРИМЕРЕ ДИАДЫ РЕЗИСТИН-ФИБРИНОГЕН // Современные проблемы науки и образования. 2019. № 6. ;URL: https://science-education.ru/ru/article/view?id=29289 (дата обращения: 04.04.2025).
DOI: https://doi.org/10.17513/spno.29289



