Причиной инфекции при перитоните могут быть самые различные бактерии [1, 2]. При этом особенности бактериальной обсемененности брюшины отражаются на течении патологического процесса в брюшной полости, влияют на симптоматику перитонита, характер течения инфекционного процесса. В процессе антибактериальной терапии состав микрофлоры изменяется в сторону преобладания устойчивых бактерий. Соответственно изменяется и этиологическая структура интраабдоминальных инфекций, развивающихся в послеоперационном периоде [1-3].
Бактериологический посев и многодневное культивирование образцов крови, перитонеальной жидкости на дифференциально-диагностических средах несвоевременно информирует о характере течения инфекционного процесса в брюшной полости и ведет к запоздалой хирургической коррекции возникающих осложнений. Следовательно, разработка простого и доступного способа быстрой диагностики спектра бактериальной контаминации брюшины остается актуальной проблемой абдоминальной хирургии.
Кроме посева, возможным вариантом определения характера бактериальной контаминации является серологическое исследование перитонеального экссудата на антигенный состав микрофлоры с помощью специфических антител или ПЦР-диагностики, однако такой тип исследований − прерогатива крупных клиник и научно-исследовательских учреждений и не подходит для массового обследования в хирургических отделениях.
Одним из путей решение данной проблемы в абдоминальной хирургии может стать разработка эквивалентов характера микрофлоры среди сывороточных белков острой фазы (БОФ) [2, 4, 5]. Зная взаимосвязь БОФ с составом микрофлоры, хирург может с определенной достоверностью (до результатов бактериологического исследования) предположить характер бактериального обсеменения брюшной полости, его количественные и качественные характеристики и, следовательно, определить оптимальный способ оперативного вмешательства с назначением адекватной антибактериальной терапии.
Предполагается взаимосвязь уровня С-реактивного белка (СРБ) со степенью инфицированности кокковой микрофлорой, прежде всего, с пневмококками [6, 7]. Имеются косвенные указания на взаимосвязь с определенными штаммами патогенных бактерий железосодержащих БОФ – ферритина и лактоферрина [8, 9]. Механизм бактериостатической активности этих белков состоит в том, что их апоформы активно аккумулируют железо, которое необходимо для развития патогенной микрофлоры [10, 11].
Ферритин (Фр) – растворимый в воде комплекс гидрофосфата железа с белком апоферритином, широко используемым в клинической практике для диагностики нарушений метаболизма железа [8, 10]. Установлена связь Фр с процессом тканевой деструкции, обязательно сопутствующим распространенным формам перитонита [8, 9, 11, 12].
Цель исследования: определить взаимосвязь между уровнем острофазового белка ферритина в сыворотке крови и перитонеальном экссудате крыс с характером бактериальной контаминации после инфицирования брюшной полости различными штаммами условно-патогенных бактерий.
Материалы и методы исследования. Работа выполнена на 90 белых крысах-самцах линии Wistar массой 180–240 г из питомника лабораторных животных ФГБУ «НИИ по изучению лепры» МЗ РФ (г. Астрахань), согласно принципам Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986).
В соответствии с задачами, животные были распределены на 6 групп, в том числе на 5 основных групп по 12 крыс в каждой и 6-ю – группу сравнения, состоящую из 30 особей. Животным основных групп однократно внутрибрюшинно были введены пять различных культур условно патогенных бактерий, а крысам 6-й группы сравнения воспроизводили асептический перитонит однократным внутрибрюшинным введением 1 мл раствора каррагинана (ООО Тинокс-Хим, Москва), который готовили, растворяя 50 мг сухого порошка препарата в 10 мл стерильного изотонического раствора хлорида натрия
Для заражения животных использовали суточные агаровые культуры аэробных грамположительных бактерий – Staphylococcus aureus, Streptococcus pyogenes (серовар A) и аэробных грамотрицательных бактерий – Proteus vulgaris, Pseudomonas aeruginosa, Klebsiella oxytoca, приготовленные на 0,9%-ном растворе хлорида натрия. Выбор этих 5 штаммов бактерий объясняется наиболее частым именно их обнаружением в перитонеальном экссудате при разлитом гнойном перитоните. Внутрибрюшинное заражение животное проводили инъекцией предварительно оттитрованных доз микроорганизмов, содержащих в объеме 0,5 мл 1×108 микробных тел стафилококка и стрептококка и 1×107 микробных тел протея, клебсиеллы и синегнойной палочки. Выбор дозы каждой бактериальной культуры был определен по 0,5 LD50, что обеспечивало выживание всех лабораторных животных более 3-х суток. Одномоментно с заражением крыс основных групп для замедления резорбции бактерий в кровь и профилактики летального сепсиса всем им внутрибрюшинно вводили раствор каррагинана по схеме и в дозе, аналогичным тем, что и при моделировании асептического перитонита у крыс 6-й группы сравнения. Через 24, 48 и 72 часа после внутрибрюшинных инъекций под эфирным наркозом путем декапитации осуществляли эвтаназию 4 животных каждой основной группы и 10 животных группы сравнения с последующим забором биоматериала.
Материалом для исследования служили сыворотка крови, полученной из яремной вены лабораторных животных, и перитонеальный экссудат, аспирированный из брюшной полости с помощью пастеровской пипетки. В качестве контроля использовали 10 образцов сывороток крови крыс различных групп, при этом кровь получали из хвостовой вены за неделю до начала эксперимента.
Уровень ферритина определяли в сыворотке крови и перитонеальной жидкости методом иммуноферментного анализа с помощью набора для определения данного железосодержащего БОФ у крыс (фирма «Cloud-Clone Corp.», США). Чувствительность теста составляет 1,7 нг/мл.
Результаты обработаны методами вариационной статистики и корреляционного анализа с применением лицензионного пакета программ MS Office Excel 2003. Статистическая значимость различий сравниваемых величин (p) между выборками оценивалась с помощью непараметрического критерия U (Вилкоксона – Манна-Уитни) для независимых выборок. Различия между выборками считались статистически достоверными при значении р < 0,05.
Результаты и их обсуждение
Использованные дозы бактерий для внутрибрюшинного инфицирования не вызывали гибели животных в течение последующих трех суток, однако при вскрытии четко присутствовали признаки перитонита различной степени тяжести.
Наблюдение за поведением животных показало, что крысы через сутки после воспроизведения перитонита отличались адинамичностью; шерсть у них была взъерошена, глаза мутные; животные отказывались от воды и пищи, живот у них был поддут, стула отсутствовал. На вскрытии у животных диагностировали разлитой перитонит: в брюшной полости жидкость в различном количестве и пласты фибрина, брюшина тусклая.
О наличии у них системной воспалительной реакции и перитонита уже через сутки после внутрибрюшинного инфицирования различными штаммами бактерий также свидетельствовало значительное (р<0,05) повышение уровня СРБ сыворотки крови во всех основных группах по сравнению с контрольными цифрами этих же животных до эксперимента.
Средний уровень Фр у интактных крыс (пробы крови получены за 9 дней до начала эксперимента) составил 29,1±2,56 нг/мл (контрольная группа) (табл. 1), что в несколько раз ниже нормальных средних уровней сывороточного Фр в крови человека.
Установлено, что в крови у крыс с асептическим перитонитом, вызванным каррагинаном, на протяжении всех трех суток наблюдения отмечалось недостоверное повышение уровня Фр (на 20–25 % выше контрольных цифр) (табл. 1). Уровень Фр в сыворотке крови крыс при асептическом перитоните стабилен на всем протяжении наблюдения (рис. А).
В первые 24 часа у крыс, зараженных бактериальными культурами одновременно с моделированием перитонита каррагинаном, в крови также не наблюдалось статистически значимого повышения уровня ферритина относительно контрольных значений, однако среди грамотрицательных бактерий только внутрибрюшинное инфицирование бактериями Proteus vulgaris никак не отражалось на концентрации ферритина в крови (табл. 1, рис. А). Другие культуры грамотрицательных бактерий (Pseudomonas aeruginosa, Klebsiella oxytoca) давали в первые сутки заражения крыс уровни Фр, превышающие контрольные в 1,4–1,5 раза.
Таблица 1
Содержание ферритина в крови и перитонеальном экссудате крыс в различные сроки после внутрибрюшинной инъекции каррагинана и бактерий
|
Фр (нг/мл) |
||||||
|
кровь |
экссудат |
|||||
|
1-е сутки |
2-е сутки |
3-е сутки |
1-е сутки |
2-е сутки |
3-е сутки |
|
|
Стрептококк (n = 4×3) |
32,0±7,37 |
55,5±7,79 Р(U)<0,05 |
48,8±9,72 |
36,3±7,31 |
69,5±9,85 Р(U)<0,05 |
60,2±9,81 |
|
Стафилококк (n = 4×3) |
25,6±5,86 |
79,8±15,29 Р(U)<0,05 |
73,4±14,95 |
35,5±7,14 |
116,8±13,05 Р(U)<0,01 |
104,2±18,69 Р(U)<0,05 |
|
Протей (n = 4×3) |
24,7±5,65 |
25,9±2,31 |
29,5±3,60 |
32,9±6,64 |
36,8±4,22 |
50,6±9,14 |
|
Псевдомонас (n = 4×3) |
44,9±10,28 |
41,0±5,70 |
44,9±9,17 |
53,7±5,57 Р(U)<0,01 |
49,8±7,06 |
61,9±9,79 Р(U)<0,05 |
|
Клебсиелла (n = 4×3) |
42,0±9,63 |
31,3±4,34 |
27,3±5,58 |
52,3±8,74 Р(U)<0,05 |
39,6±4,12 |
30,3±5,44 |
|
Каррагинан (n = 7×3) |
36,1±5,18 |
33,1±4,66 |
33,2±6,22 |
56,7±6,91 Р(U)<0,01 |
40,0±5,61 |
38,1±5,68 |
|
Контроль (n = 10) |
29,1±2,56 |
− |
||||
Примечание: Р(U) – статистически значимые различия с контролем (по непараметрическому U-критерию Вилкоксона – Манна-Уитни).
Через 48 часов после инфицирования грамположительными бактериями в крови крыс статистически значимо более чем в два раза повышается концентрация Фр (табл. 1), которая при стрептококковой инфекции имеет к 3-м суткам тенденцию к снижению, а при стафилококковой − к 3-м суткам остается на высоких цифрах, в 2,5 раза превышающих контрольные уровни Фр (рис. А). В крови животных, зараженных грамотрицательными бактериями, на 2-е и 3-и сутки исследования сывороточные концентрации Фр или сохраняются на одном и том же низком уровне (Proteus, Pseudomonas), или плавно снижаются (Klebsiella).
В отличие от сывороточных уровней Фр, начиная с 1-х суток и во все последующие дни, нами обнаружены более высокие концентрации Фр в перитонеальной жидкости крыс во всех шести основных группах (табл. 1), что позволило ввести новый коэффициент (Фрэкс / Фрсыв) − отношение концентрации Фр в перитонеальном экссудате к концентрации сывороточного Фр крыс (табл. 2).
Обнаружено, что средние концентрации Фр в перитонеальной жидкости были всегда выше, чем средние концентрации этого белка в сыворотке крови этой же группы крыс. Методами корреляционного анализа между уровнями Фр в крови и перитонеальной жидкости крыс подтверждена тесная прямая связь (r = +0,99). Вычислены коэффициенты корреляции в зависимости от характера микробного заражения (табл. 2).
Таблица 2
Отношения Фрэкс / Фрсыв и коэффициенты корреляции r между содержанием ферритина в крови и перитонеальном экссудате крыс в различные сроки после внутрибрюшинной инъекции каррагинана и бактерий
|
Фрэкс / Фрсыв и степень корреляции, r |
|||
|
1-е сутки |
2-е сутки |
3-е сутки |
|
|
Стрептококк (n = 4×3) |
1,13 0,99 |
1,25 0,95 |
1,23 0,97 |
|
Стафилококк (n = 4×3) |
1,39 0,99 |
1,46 0,95 |
1,42 0,95 |
|
Протей (n = 4×3) |
1,33 0,99 |
1,42 0,98 |
1,72 0,96 |
|
Псевдомонас (n = 4×3) |
1,20 0,99 |
1,21 0,95 |
1,38 0,88 |
|
Клебсиелла (n = 4×3) |
1,25 0,99 |
1,27 0,95 |
1,11 0,91 |
|
Каррагинан (n = 7×3) |
1,57 0,99 |
1,21 0,99 |
1,15 0,98 |
Обнаружено, что в перитонеальной жидкости крыс с асептическим перитонитом, вызванным каррагинаном, через 24 часа после внутрибрюшинной инъекции концентрация Фр почти в 2 раза превышает контрольные цифры Фр в крови крыс (Р(U)<0,01). Кроме того, в этот срок уровень Фр в экссудате при асептическом перитоните даже выше, чем при инфекционных перитонитах у крыс остальных 5 основных групп (табл. 1). В последующие дни при асептическом перитоните наблюдается падение уровня Фр в экссудате (рис. Б) до уровня, статистически незначимого – всего на четверть превышающего контрольные цифры (табл. 1).
В первые 24 часа у крыс, зараженных бактериальными культурами грамположительных бактерий, концентрация Фр в перитонеальной жидкости практически не отличается от контроля, через 48 часов статистически значимо возрастает в 4 раза для стафилококка (Р<0,01) и в 2,4 раза для стрептококка (Р<0,05), сохраняясь на высоких цифрах и через 72 часа (табл. 1, рис. Б). При этом уровень Фр при стафилококковом инфицировании на 3-е сутки статистически значимо (Р<0,05) повышен в 3,5 раза.
При инфицировании бактериями Proteus наблюдается постепенное нарастание уровня ферритина в перитонеальном экссудате, однако статистически значимых величин от контрольных концентраций Фр не достигает (табл. 1, рис. Б).
Наоборот, культуры грамотрицательных бактерий Pseudomonas и Klebsiella давали в первые сутки заражения крыс концентрации Фр, статистически значимо превышающие контрольные в 1,4–1,5 раза (табл. 1). Этот высокий уровень Фр после первых суток не сохранялся и резко снижался на 2-е – 3-и сутки в обеих группах (табл. 1, рис. Б).
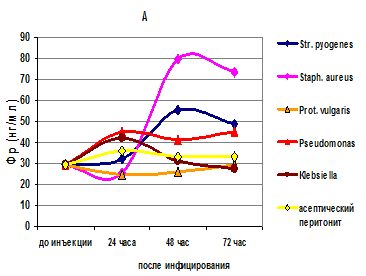
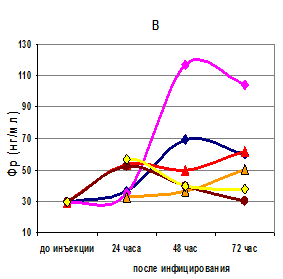
Динамика изменения уровня Фр в сыворотке крови (А) и перитонеальном экссудате (В) крыс после внутрибрюшинного заражения различными штаммами бактерий
Заключение
Установлено, что при одновременном внутрибрюшинном введении каррагинана и заражении крыс культурой грамположительных бактерий Staphylococcus aureus, Streptococcus pyogenes в дозах 1×108 микробных тел или грамотрицательных бактерий Proteus vulgaris, Pseudomonas aeruginosa, Klebsiella oxytoca в дозах 1×107 микробных тел развивается гнойный перитонит различной степени тяжести, а в крови и перитонеальном экссудате животных после инфицирования крыс любой из 5 монокультур условно-патогенных бактерий повышается концентрация Фр, причем его уровень в перитонеальной жидкости в среднем всегда был выше, чем в крови экспериментальных животных.
После введения стрептококка уровень Фр достоверно повышен в крови и в экссудате на 2-е сутки, после стафилококка − на 2-е и 3-и сутки. Синегнойная палочка дает две волны достоверного повышения Фр в перитонеальном экссудате на 1-е и 3-и сутки после внутрибрюшинного инфицирования. При этом в крови экспериментальных животных прослеживается аналогичная динамика. Внутрибрюшинное заражение клебсиеллой приводит к быстрому и значимому повышению концентрации ферритина, уже начиная с 1-х суток, и к последующему плавному снижению Фр в крови и перитонеальной жидкости зараженных крыс. Сходная с клебсиеллой динамика изменения концентрации Фр по сравнению с контролем наблюдалась также в группе сравнения у животных, которым моделировался каррагинановый асептический перитонит.
Полученные результаты могут быть использованы в дальнейшем для разработки метода, позволяющего с определенной степенью вероятности до получения результатов микробиологических исследований перитонеального экссудата предположить характер бактериальной обсемененности брюшной полости путем определения содержания Фр в двух биологических жидкостях с расчетом коэффициента отношений концентрации Фр в сыворотке крови и перитонеальной жидкости.
Библиографическая ссылка
Мусагалиев А.А., Коханов А.В., Воронкова М.Ю., Серебряков А.А., Муртузалиев И.М. УРОВНИ ФЕРРИТИНА В СЫВОРОТКАХ КРОВИ И ПЕРИТОНЕАЛЬНОМ ЭКССУДАТЕ КРЫС ПРИ ВНУТРИБРЮШИННОМ ИНФИЦИРОВАНИИ МОНОКУЛЬТУРОЙ БАКТЕРИЙ // Современные проблемы науки и образования. – 2017. – № 5. ;URL: https://science-education.ru/ru/article/view?id=26748 (дата обращения: 21.11.2024).



